
„Wenn Stress dazukommt, könnte die Energieversorgung zu einem Problem werden“
Prof. Dr. Karin Busch erforscht am Institut für Integrative Zellbiologie und Physiologie die Bioenergetik von Zellen, also die Prozesse der Energieumwandlung, die für das Leben unerlässlich sind. In aktuellen Studien hat sie mit Prof. Dr. Guiscard Seebohm (Medizinische Fakultät) und Prof. Dr. Verónica Eisner (Päpstliche Katholische Universität, Santiago de Chile) in einem deutsch-chilenischen Team untersucht, wie sich Strukturen in den Mitochondrien, auch bekannt als „Kraftwerke“ der Zelle, im Herzmuskel mit zunehmendem Alter verändern. Im Gespräch mit Christina Hoppenbrock gibt sie Einblicke in die Forschung.
Welche Bedeutung haben die beobachteten Strukturänderungen in den „Zellkraftwerken“?
Sie könnten eine Art ‚Vorwarnsystem‘ für altersbedingte Herzerkrankungen sein. Die Veränderungen, die mit einer reduzierten Kapazität der Energieversorgung einhergehen, sind an sich wohl nicht krankhaft. Aber wenn zusätzlicher Stress für das Herz dazukommt, beispielsweise eine chronische Entzündung oder eine andere Erkrankung, dann könnte die eingeschränkte Energieversorgung der Herzmuskelzellen zu einem ernsthaften Problem werden. Denn bei solchen Herausforderungen benötigt das Herz mehr Energie.
Jede Zelle im Körper benötigt Energie. Der universelle Energieträger im Körper ist Adenosintriphosphat, kurz ATP. Mitochondrien stellen ATP aus Fettsäuren oder Glucose-Abbauprodukten besonders effektiv her, verglichen mit der Energiegewinnung durch den Abbau von Kohlenhydraten bei der Glykolyse. Die Glykolyse findet an einem anderen Ort in den Zellen statt, im Zytoplasma.
Sie haben sich speziell die Mitochondrien in Herzmuskelzellen angeschaut. Was ist daran besonders?
Die unterschiedlichen Gewebe und Organe im Körper nutzen verschiedene Energiequellen. Für ihre Aktivität benötigen die Herzmuskelzellen eine möglichst effiziente Energieversorgung. Daher sind sie besonders darauf angewiesen, dass sie funktionierende Mitochondrien haben, die ihnen die Energie bereitstellen.

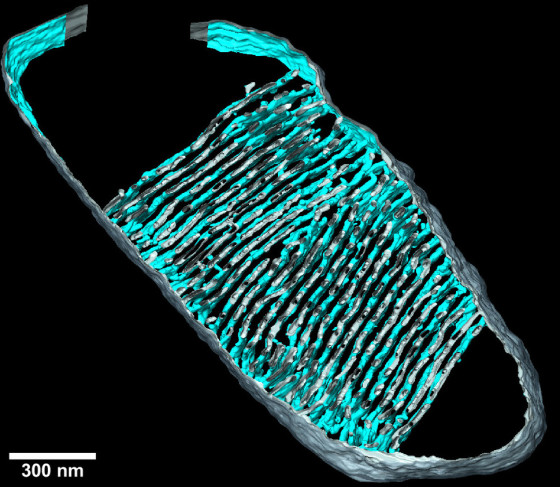
Einerseits die Architektur der inneren Membran in den Mitochondrien. Dazu muss man wissen, dass Mitochondrien von einer doppelten Membran umgeben sind. Die innere Membran hat Einstülpungen, sogenannte Cristae. Sie sind der Ort der oxidativen Phosphorylierung, einer Kette von gekoppelten Reaktionen, die ATP liefert. Wir haben zusätzlich den Proteinkomplex, der das ATP produziert, die ATP-Synthase, im Detail untersucht.
Was passiert, wenn das Herz altert?
Die Dichte der Cristae nimmt bereits früh im Alterungsprozess des menschlichen Herzens ab. Zu diesem Zeitpunkt ist die Menge ihrer formgebenden Proteine jedoch noch unverändert. Mit tomographischer Bildgebung haben wir bei älteren Mäusen gezeigt, dass die Cristae weniger vernetzt sind, schmaler werden und immer mehr ‚Löcher‘ haben – wir sprechen von ‚Fenstern‘ in der Membran. Diese Änderungen waren mit einem Verlust des Cristae-formgebenden Proteins ‚Opa1‘ verbunden. Außerdem haben wir menschliche Herzmuskelzellen in Zellkultur zum Altern gebracht. Dabei haben wir gesehen, dass die ATP-Synthase, die normalerweise in den Krümmungen der Cristae sitzt, beweglicher wird. Sie sitzt also weniger fest an ihrem Platz. Wir gehen davon aus, dass sie dadurch nicht mehr so effizient arbeitet.
Originalveröffentlichungen:
Isidora Molina-Riquelme, Gonzalo Barrientos, Leonhard Breitsprecher, +8, and Karin B. Busch, Verónica Eisner (2025): Multiscale mitochondrial cristae remodeling links Opa1 downregulation to reduced OXPHOS capacity in aged hearts. PNAS; DOI: 10.1073/pnas.2508911123
Silke Morris, Nico Marx, Gonzalo Barrientos, Isidora Molina-Riquelme, Frank Schmelter, Hugo E. Verdejo, Stefan Peischard, Guiscard Seebohm, Verónica Eisner, Karin B. Busch (2026): Disruption of ATP Synthase Spatiotemporal Organization, Ca2+ Dynamics, and Contractile Function in Senescent Cardiomyocytes. Aging Cell; DOI: 10.1111/acel.70388
