Mikroskope: Tiefe Einblicke in verborgene Welten
Wie der Kosmos oder die Tiefsee fasziniert die Mikro- und Nanowelt viele Menschen. Sie erscheint unzugänglich und bleibt den Blicken der Betrachter scheinbar verborgen. Doch über verschiedene Fachdisziplinen hinweg ermöglichen Mikroskope immer tiefere, genauere und höher aufgelöste Blicke auf allerkleinste Details – bis hin zu atomaren Strukturen. Die Geräte, die die Forscherinnen und Forscher dafür nutzen, sind hoch komplex. Mit den einfachen Lichtmikroskopen, die viele Menschen aus dem Schulunterricht kennen, haben sie kaum etwas gemeinsam. Die Fluoreszenzmikroskopie beispielsweise ist eine lichtmikroskopische Methode, bei der Biomoleküle innerhalb des Präparats mit Fluoreszenzfarbstoffen markiert werden und das von ihnen abgestrahlte Licht sichtbar gemacht wird. In der Forschung werden noch weitere Mikroskopieverfahren eingesetzt, die auf anderen physikalischen Prinzipien beruhen, wie die Elektronen- und die Rastersondenmikroskopie. Auf dieser Themenseite stellen wir einige der Geräte vor, die Wissenschaftlerinnen und Wissenschaftler aus den Natur- und Lebenswissenschaften an der Universität Münster nutzen, und geben dabei einen Einblick in die Forschung.
Tieftemperatur-Rastertunnelmikroskop
Schon ein einziges fehlendes oder andersartiges Atom kann die Eigenschaften von ultradünnen, zweidimensionalen Materialien beeinflussen. Beispielsweise kann solch ein Defekt dazu führen, dass das Material einzelne Photonen abgibt – das macht es interessant für mögliche optoelektronische Anwendungen. Für Mechanismen wie diesen interessiert sich die Arbeitsgruppe von Prof. Dr. Anika Schlenhoff am Physikalischen Institut: Wie hängen beispielsweise die strukturellen Eigenschaften von 2-D-Materialien mit ihren elektronischen oder magnetischen Eigenschaften zusammen? Das Team untersucht die Probenoberflächen mit einem Rastertunnelmikroskop, das jedes einzelne Atom der Probenoberfläche sichtbar machen kann – und auch die Lücken, wenn ein Atom fehlt. „Je kleiner die Abmessungen des 2-D-Materials sind, umso bedeutender sind atomare Defekte“, erklärt Anika Schlenhoff. „Wenn man versteht, wie etwa solche Fehlstellen die Materialeigenschaften verändern, kann man sie gezielt erzeugen, um die Eigenschaften zu steuern.“ Das Rastertunnelmikroskop gehört zu den Rastersondenmikroskopen, bei denen eine Messsonde die Oberfläche „abtastet“. Eine feine, leitfähige Messspitze gleitet dicht über die elektrisch leitende Oberfläche, ohne sie zu berühren. Der sogenannte Tunnelstrom, der zwischen Probe und Spitze fließt, erlaubt Rückschlüsse auf die Elektronenverteilung und damit auf die Oberflächenstruktur – bis hin zur Anordnung der einzelnen Atome und deren Unterscheidung.
Das Gerät der AG Schlenhoff, das im Center for Soft Nanoscience (SoN) untergebracht ist, arbeitet bei sehr kalten Temperaturen bis unter fünf Kelvin (etwa -268 Grad Celsius). Die frostigen Temperaturen sorgen für eine stabile Positionierung der Messspitze über den einzelnen Oberflächenatomen und für eine hohe Qualität des Messsignals. Eine Besonderheit des Geräts ist seine Kopplung mit einem Versuchsaufbau, der die optische Anregung der Probenoberfläche erlaubt. So kann das Team Rückschlüsse auf die optoelektronischen Eigenschaften der Probe ziehen und diese mit den strukturellen und elektronischen Eigenschaften in Beziehung setzen.
Autorin: Christina Hoppenbrock
Infrarot-Mikroskop mit Spektrometer
Seit zwei Jahren verfügt die Arbeitsgruppe von Prof. Dr. Harald Hiesinger am Institut für Planetologie (Fachbereich Geowissenschaften) über ein Instrument, das es in dieser Kombination nur wenige Male in Deutschland gibt: ein Spektrometer mit angebautem Infrarot-Mikroskop. Kosten: rund 350.000 Euro. In der Spektroskopie geht es darum, dass verschiedene Materialien – in diesem Fall Minerale – bestimmtes Licht absorbieren, reflektieren oder emittieren, wodurch ein Spektrum entsteht, das charakteristisch für das jeweilige Material ist. Es ist jedoch schwierig, das Spektrum von reinen Mineralen zu bestimmten, da diese in der Natur meist Verunreinigungen aufweisen, die das Spektrum verändern. Hier kommt das Mikroskop ins Spiel: Es ermöglicht, einzelne, teils nur wenige Mikrometer große Stellen einer Probe zu untersuchen. Das Mikroskop arbeitet dabei im mittleren Infrarot-Spektrum mit Licht von Wellenlängen im Bereich von zwei bis 20 Mikrometern. Der durch das Mikroskop vergrößerte Punkt auf der Probe wird mit infrarotem Licht bestrahlt, um das reflektierte Licht dann im Spektrometer untersuchen zu können.
Das Ziel ist es, eine Datenbank aufzubauen, in der die Spektren möglichst vieler Materialen gespeichert sind, welche später die verschiedenen Minerale wie einen Fingerabdruck identifizieren können. Dieses grundlegende Verständnis von Spektren hilft zum Beispiel dabei, die Oberfläche und Beschaffenheit verschiedener Himmelskörper zu untersuchen. Aktuell fliegt die Raumsonde BepiColombo Richtung Merkur und hat auch ein Spektrometer an Bord, das vom Team um Harald Hiesinger betreut wird. Wenn die Daten dieser Sonde ab 2026 vorliegen, können sie dank der Spektren-Datenbank ausgewertet werden.
Autor: Patrick Dietz
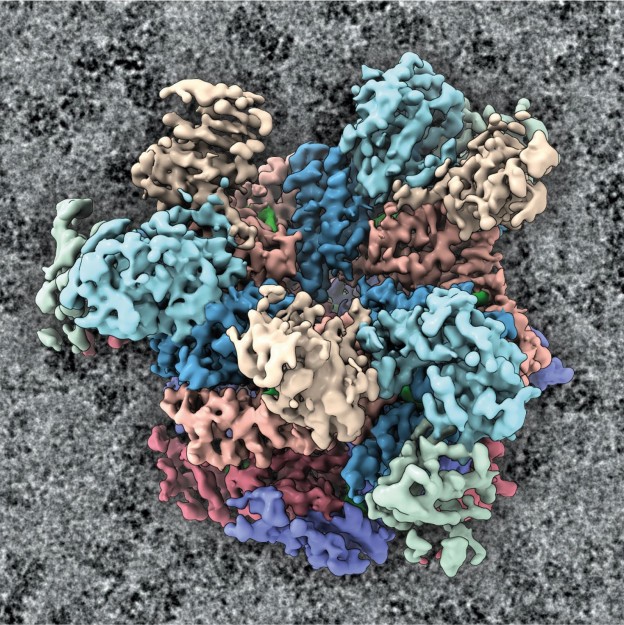
Hochleistungs-Kryoelektronenmikroskop
Die Arbeitsgruppe „KryoEM komplexer Nanosysteme“ des Instituts für Medizinische Physik und Biophysik der Medizinischen Fakultät widmet sich der Aufklärung der Architektur komplexer Nanomaschinen durch deren direkte Visualisierung mittels Kryo-Elektronenmikroskopie. Dies beinhaltet häufig die Untersuchung von Zielproteinen im Inneren von Zellen. Neben der eigenen Forschung unterstützt die AG Wissenschaftlerinnen und Wissenschaftler aus den Natur- und Lebenswissenschaften an der Universität Münster, die feinste Details von Proteinen untersuchen wollen. Die Gruppe, die vom Biologen Prof. Dr. Christos Gatsogiannis geleitet wird, verfügt am Center for Soft Nanoscience über ein Hochleistungs-Kryoelektronenmikroskop (Kryo-EM), das seinesgleichen sucht. Bundesweit gibt es lediglich etwa eine Handvoll vergleichbarer Geräte.
Das Kryo-EM kann kleinste Bestandteile von Zellen sichtbar machen, bis hin zu einzelnen Atomen. Dadurch können die Forscher die Prozesse im Zellinneren nachvollziehen. Außerdem ist das Mikroskop in der Lage, dreidimensionale Proteinstrukturen sichtbar zu machen. Das Kryo-EM ist ein Transmissions-Elektronenmikroskop, bei dem mikroskopische Objekte durch Elektronenstrahlen bei extrem niedrigen (kryogenen) Temperaturen abgebildet werden. „Um die Elektronen zu beschleunigen, benötigen wir eine Spannung von 300.000 Volt“, berichtet Kryo-EM-Experte Dr. Alexander Neuhaus. Das Hochleistungs-Kryo-EM erreicht eine Auflösung von fast einem Ångström, also etwa einem zehnmillionstel Millimeter. Das entspricht der Größenordnung von Atomradien. Die digitale Kamera- und Verarbeitungstechnik schafft bis zu 20.000 Einzelaufnahmen in 24 Stunden. Jede Bilddatei hat eine Größe von 16 Megabyte; die Daten werden über den universitätseigenen Hochleistungsrechner „PALMA II“ prozessiert. Etwa 15 Arbeitsgruppen nutzen die 7,5 Millionen Euro teure Infrastruktur bereits, die mit Unterstützung der Deutschen Forschungsgemeinschaft und des Landes Nordrhein-Westfalen angeschafft und im Frühjahr 2023 eingeweiht wurde. Weitere Gruppen werden folgen.
Autorin: Christina Hoppenbrock
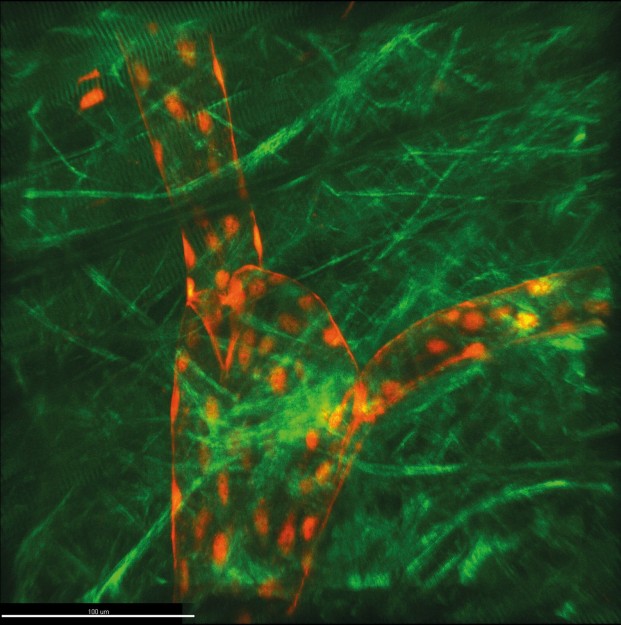
Drei-Photonen-Mikroskop
In der Arbeitsgruppe „Intravitale molekulare Bildgebung“ von Prof. Dr. Friedemann Kiefer (Fachbereich Medizin) steht seit einigen Wochen ein neues technisches Gerät, das die Herzen vieler Forscherinnen und Forscher im Team höherschlagen lässt: das sogenannte Drei-Photonen-Mikroskop, das individuell für die Wissenschaftler und deren Fragestellungen gebaut wurde. „Weltweit existieren nur wenige Apparate dieses Kalibers. Es ermöglicht, Lichtstreuung und -absorption als die limitierenden Faktoren für die erreichbare Abbildungstiefe in der optischen 3-D-Mikroskopie stärker als bislang zu reduzieren. Nun können wir dreidimensionale Aufnahmen von lebenden Geweben machen, die anderweitig für die Bildgebung nicht möglich sind“, erklärt Friedemann Kiefer. Die Drei-Photonen-Mikroskopie ist ein Fluoreszenzmikroskopie-Verfahren. Die Wissenschaftler setzen diese Technik ein, um Prozesse bis auf die molekulare Ebene im lebenden Organismus zu untersuchen, beispielsweise die Sauerstoffversorgung oder die Reaktion von Organen auf Reize wie Entzündungen.
Die Mikroskopie am lebenden Organismus nennt man Intravitalmikroskopie. Anstelle energiereichen, kurzwelligen Anregungslichts, wie sie die konfokale Mikroskopie nutzt, verwendet die Drei-Photonen-Mikroskopie besonders niederenergetisches, langwelliges Licht, um einen Fluoreszenzfarbstoff anzuregen. Das langwellige infrarote Licht wird weniger gestreut und kann tiefer in lebendes Gewebe eindringen. Dadurch ermöglicht die Drei-Photonen-Mikroskopie Bildgebung bis zu einem Millimeter, manchmal sogar tiefer in der Probe, bei sehr geringen Hintergrundsignalen. Da bei diesem Verfahren drei Photonen gleichzeitig mit einem Fluoreszenzfarbstoff wechselwirken müssen, setzt man sehr kurze, nur wenige Femtosekunden dauernde Laserpulse mit einer hohen Photonendichte ein. Ein positiver Nebeneffekt der extrem kurzen Pulsdauer ist eine minimale Schädigung des lebenden Gewebes.
Autorin: Kathrin Kottke
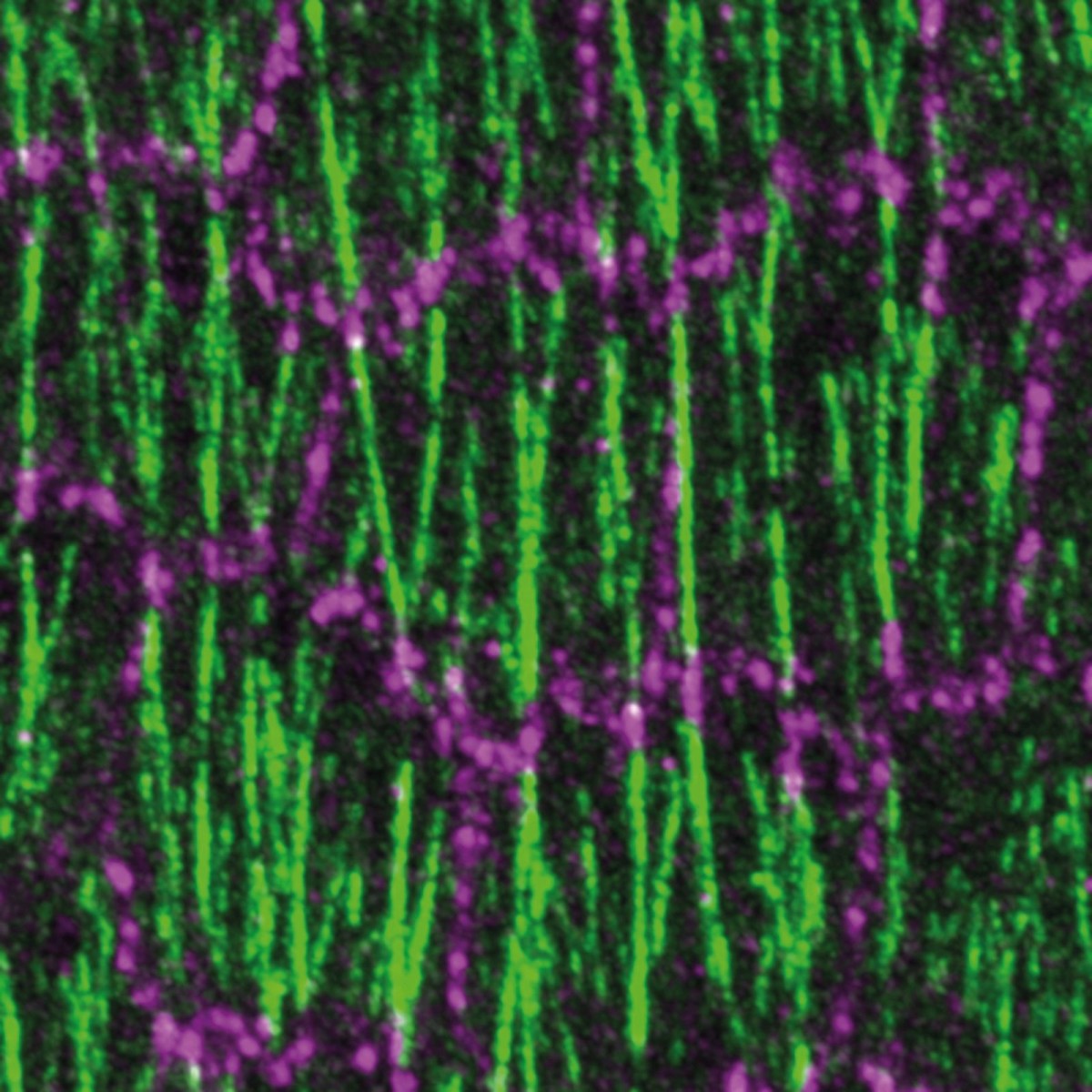
Konfokales Laser-Scanning-Mikroskop
Zelluläre Prozesse der Organentwicklung stehen im Fokus der Wissenschaftlerinnen und Wissenschaftler der Arbeitsgruppe von Prof. Dr. Stefan Luschnig am Institut für Integrative Zellbiologie und Physiologie des Fachbereichs Biologie, etwa der Umbau von Zellkontakten in der Taufliege. Um diese Prozesse bis ins molekulare Detail sichtbar zu machen, nutzen sie ein konfokales Laser-Scanning-Mikroskop, ein spezielles Fluoreszenzmikroskop, das bei einer Auflösung von 200 Nanometern ein detailliertes Bild von den Strukturen in Zellen darstellt. Dabei kommt ein optischer Trick zur Anwendung: Während normale Lichtmikroskope das ganze Präparat ausleuchten, verwendet das konfokale Mikroskop einen Laser, der den zu untersuchenden Bereich Punkt für Punkt rastert. Eine Software setzt anschließend die Informationen zu einem Bild zusammen – beispielsweise die Ovarien (Eierstöcke) der Taufliege, bei der zuvor bestimmte Proteine genetisch mit fluoreszierenden Molekülen markiert wurden. Bei der Mikroskopieaufnahme wird das Fluoreszenzlicht durch eine Lochblende gebündelt und die Bereiche außerhalb des Fokus ausgeblendet. So entsteht am Ende ein Bild ohne störende Überlagerungen. „Damit können wir extrem scharfe Bilder aus dem Inneren von Embryonen und Zellen machen. Wie gut man damit inzwischen in Zellen hineinschauen kann, war vor einigen Jahren kaum vorstellbar. Nun schauen wir uns die zellulären Vorgänge quasi ‚live‘ an“, beschreibt Stefan Luschnig.
Das Gerät für rund 400.000 Euro steht seit 2018 nicht nur dem Team von Stefan Luschnig zur Verfügung, sondern allen Wissenschaftlern der Universität Münster. Über das „Imaging Network“, ein Kooperationsnetzwerk des Cells in Motion Interfaculty Centres, können das Mikroskop und viele andere Geräte gebucht werden.
Autorin: Kathrin Kottke
Hintergrund: Forschungsinfrastruktur gemeinsam nutzen
Das Konfokale Laser-Scanning-Mikroskop aus der AG Luschnig und das Drei-Photonen-Mikroskop aus der AG Kiefer sind Teil des „Imaging Network“ – ein Kooperationsnetzwerk des Cells in Motion Interfaculty Centres, zu dem 50 Geräte gehören. Alle Wissenschaftlerinnen und Wissenschaftler der Universität Münster können über das Netzwerk Geräte, Methoden und Expertisen nutzen und zur Verfügung stellen. Aktuell nutzen über 500 Personen das Netzwerk.
Dieser Artikel stammt aus der Unizeitung wissen|leben Nr. 6, 4. Oktober 2023.