Bedeutung einzelner Moleküle bei mechanischer Belastung in Zellen nachgewiesen
Die Zellen unseres Körpers sind kontinuierlich mechanischen Kräften ausgesetzt, die entweder von außen einwirken oder von Zellen selbst generiert werden. Auf solche mechanischen Reize reagieren zu können, ist eine unabdingbare Voraussetzung für eine Vielzahl biologischer Prozesse. Wie es den Zellen gelingt, mechanische Reize zu verarbeiten, ist jedoch kaum verstanden, denn es fehlt an Techniken, um die sehr feinen mechanischen Signale zu untersuchen. Forscher der Westfälischen Wilhelms-Universität (WWU) Münster haben nun eine Methode entwickelt, mit der die Mechanik einzelner Moleküle verändert und dadurch analysiert werden kann. Die Arbeit ist in der Fachzeitschrift Science Advances veröffentlicht.
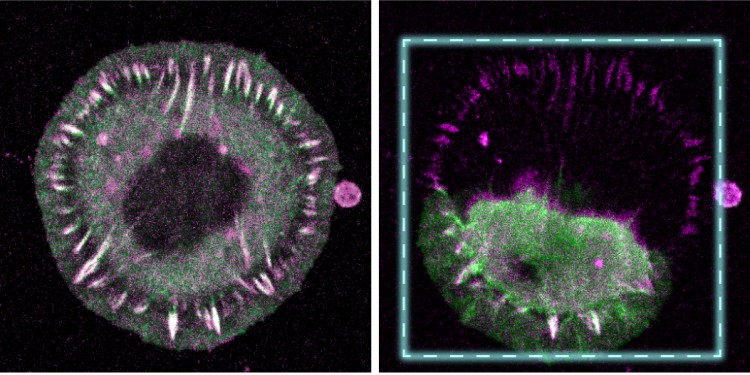
Die Arbeitsgruppe um den Zellbiologen Prof. Dr. Carsten Grashoff entwickelte ein Verfahren, bei dem Proteine mithilfe eines lichtempfindlichen Moleküls verändert und durch kurze Lichtimpulse mechanisch gesteuert werden können. Den Wissenschaftlern gelang es auf diese Weise, einzelne Proteine mit hoher zeitlicher und räumlicher Kontrolle zu brechen, um anschließend deren mechanische Bedeutung in Zellen zu untersuchen. So wiesen sie die Funktion von zwei Molekülen nach, die für die Adhäsion, also das Anhaften, von Zellen im Körper wichtig sind. Beide Moleküle stehen im Verdacht, bei einer Reihe von Erkrankungen eine zentrale Rolle zu spielen. Das Talin-Protein ist unerlässlich, um mechanische Kräfte während der Adhäsion von Zellen an das Bindegewebe zu tragen – ein Prozess, der zum Beispiel bei der Zellwanderung von großer Bedeutung ist. Das Desmoplakin-Protein ist hingegen wichtig, um mechanischem Stress in Zell-Zell-Verbindungen zu widerstehen, welche in Epithelgeweben wie der Haut vorkommen.
„Zusammen liefern diese Ergebnisse einen Nachweis, wie die mechanischen Eigenschaften bestimmter Zellstrukturen von einzelnen Proteinen gesteuert werden können“, betont Carsten Grashoff. Da die entwickelte Technik zur Modifikation der Proteine genetisch verschlüsselt ist und daher an beliebiger Stelle in das Erbgut eingebracht werden kann, erhoffen sich die Forscher eine breite Anwendbarkeit, um die Erforschung mechanobiologische Eigenschaften vieler anderer Proteine in lebenden Zellen, Modellorganismen und Krankheitsmodellen möglich zu machen.
Zum Hintergrund: Mechanische Reize werden in Zellen, wie viele andere Signale auch, letztlich auf der Ebene einzelner Proteine verarbeitet. Zwar haben Forscher in den vergangenen Jahren eine Reihe von Molekülen identifiziert, die mechanischen Kräften in Zellen direkt ausgesetzt sind. Es blieb jedoch oft unklar, wie wichtig die mechanischen Beiträge einzelner Proteine für die oft sehr komplexen zellbiologischen Prozesse sind.
Das Experiment des Teams um Carsten Grashoff gelang durch die Verwendung einer lichtempfindlichen Verbindung, die zwar hohen mechanischen Kräften widerstehen kann, bei Lichtbestrahlung aber auseinanderbricht. Vergleichbare, lichtempfindliche Proteine finden sich auch in Pflanzen, wo sie die Ausrichtung der Pflanze zum Licht regulieren. Durch das gezielte Einbringen dieser molekularen Sollbruchstelle mithilfe molekularbiologischer Methoden in die Sequenz bestimmter Gene (Talin, Desmoplakin) stellte das Team Zellen des Bindegewebes und der Haut her, die mit einem Laserstrahl auf Ebene einzelner Proteine gesteuert werden können. Die Modulation und Analyse der lebenden Zellen, die aus Zellkulturmodellen der Maus stammen, erfolgte mit Hilfe fluoreszenzmikroskopischer Methoden.
Forschungsförderung
Die Deutsche Forschungsgemeinschaft (DFG), die Volkswagen-Stiftung und der Europäische Forschungsrat unterstützten die Arbeit finanziell.
Originalpublikation
Tanmay Sadhanasatish, Katharina Augustin, Lukas Windgasse, Anna Chrostek-Grashoff, Matthias Rief and Carsten Grashoff (2023): A molecular optomechanics approach reveals functional relevance of force transduction across talin and desmoplakin. Science Advances Vol 9, Issue 25; DOI: 10.1126/sciadv.adg3347
