Pflanzen messen im Boden verfügbare Mangankonzentration mit der Wurzel
Jedes Lebewesen benötigt das Element Mangan als essenziellen Nährstoff. In Pflanzen ist es beispielsweise maßgeblich daran beteiligt, während der Photosynthese Wasser in Sauerstoff und Wasserstoff aufzuspalten. Ein deutsch-chinesisches Forscherteam hat nun bei der Acker-Schmalwand (Arabidopsis thaliana) erstmals gezeigt, wie Pflanzen einen Manganmangel wahrnehmen und welche Prozesse auf molekularer Ebene in der Pflanze stattfinden. Die Forscher wiesen nach, dass eine bisher unentdeckte Zellgruppe in der Pflanzenwurzel dabei eine entscheidende Rolle spielt. Von den Ergebnissen erhoffen sich die Wissenschaftler perspektivisch Ansätze, um Pflanzen gegen Manganmangel widerstandsfähiger zu machen. Manganmangel kommt häufig in alkalischen und kalkhaltigen Böden vor.
Prof. Dr. Jörg Kudla vom Institut für Biologie und Biotechnologie der Pflanzen der Westfälischen Wilhelms-Universität (WWU) Münster, einer der federführenden Autoren der Studie, unterstreicht: „Bislang war recht gut untersucht, welche Proteine an der Mangan-Aufnahme und am -Transport innerhalb der Zelle beteiligt sind. Wie der Manganhaushalt auf der Ebene des Organismus reguliert wird, ist jedoch Neuland.“ Da Kalzium als Botenstoff an zahlreichen anderen Steuerungsprozessen in der Pflanze mitwirkt, fragten sich die Forscher, ob es auch die Steuerung des Manganhaushalts beeinflusst.
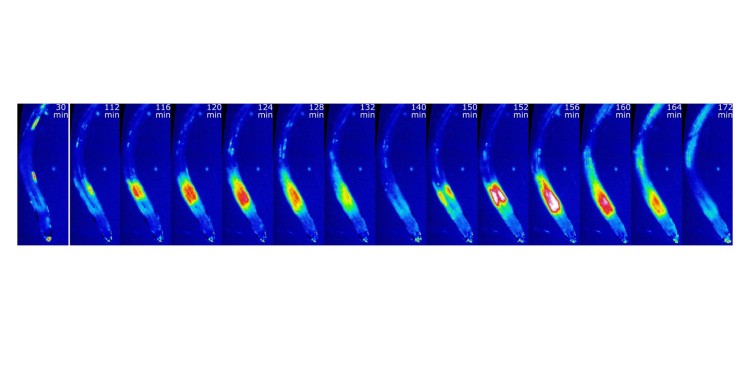
Das Team identifizierte eine spezielle Zellgruppe in der Pflanzenwurzel und taufte sie „Mangan-empfindliche Nische“. Diese Zellen zeigen – im Gegensatz zu allen anderen Wurzelzellen – bei Manganmangel eine besondere Reaktion: Die Kalziumkonzentration innerhalb der Zellen steigt an und fällt ab, mehrmals hintereinander, solange der Mangelzustand anhält. Jede Oszillation dauert ungefähr 30 Minuten. „So eine Oszillation der Kalziumkonzentration, die durch die koordinierte Bildung von Kalziumsignalen in einzelnen Zellen aufgebaut wird, hat in Pflanzen vorher noch niemand beobachtet“, betont Jörg Kudla. Wenige Hundert Zellen bauen das Signal gemeinsam auf. Erst beginnen die Epidermiszellen, also die Zellen der äußersten Wurzelschicht, mit der Erhöhung der Kalziumkonzentration. Dann schließen sich die weiter innen liegenden Zellen nach und nach an, bevor sich der gesamte Prozess umkehrt.
Bereits dritte reizspezifische „empfindliche Nische“ entdeckt
Wissenschaftler um Jörg Kudla hatten in vorherigen Arbeiten bereits zwei weitere „empfindliche (sensitive) Nischen“ in anderen Bereichen der Wurzel entdeckt: Eine Kalium-empfindliche Nische sowie eine Natrium-empfindliche Nische. Auch dort reagieren die Wurzeln mit der Bildung von mehrzelligen Kalziumsignalen in spezifischen Zellgruppen auf Änderungen der Ionenkonzentration in der Umwelt. Allerdings beobachteten die Wissenschaftler im Gegensatz zur Mangan-sensitiven Nische keine Oszillation.
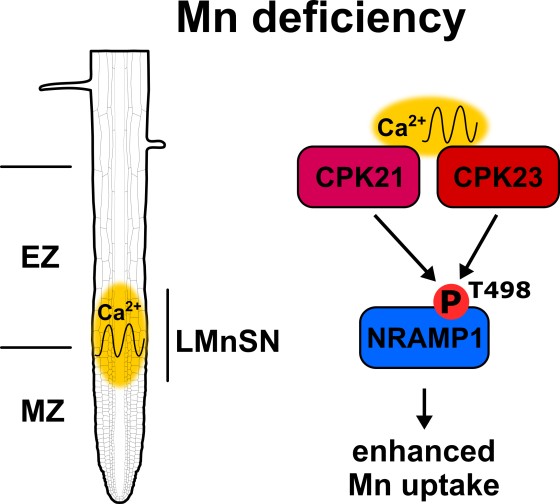
Die Forscher haben in der aktuellen Studie auf molekularer Ebene herausgefunden, dass die durch den Manganmangel ausgelösten Kalzium-Oszillationen zwei spezielle Enzyme, sogenannte Kalzium-abhängige Proteinkinasen (CPK21 und CPK23), aktivieren und diese wiederum die Manganaufnahme ankurbeln. „Da das Kalzium sich wieder von den Kinasen löst und sie dann wieder inaktiv werden, ist unsere Hypothese, dass jede Oszillation diesen Prozess neu startet – so lange, bis die Pflanze ausreichend Mangan aufgenommen hat“, sagt Jörg Kudla. Teil des Prozesses ist der Mangan-Transporter NRAMP1, der für den Transport von Mangan in die Zellen der Wurzel verantwortlich ist. Die Proteinkinasen CPK21 und CPK23 interagieren mit diesem Transporter und regulieren über die Phosphorylierung einer Aminosäure (Thr498) die Manganaufnahme.
Um die Kalziumsignale nachzuweisen, setzten die Forscher hochauflösende Mikroskopie und – erstmals besonders sensitive – molekulare Kalzium-Biosensoren ein. Biosensoren machen Konzentrationsänderungen bioaktiver Substanzen wie Kalzium in Zellen und Geweben sichtbar. Diese „In vivo Biosensorik“-Studien kombinierte das Team mit genetischen, zellbiologischen und biochemischen Methoden, um die zugrunde liegenden molekularen Mechanismen aufzuklären. Neben den Münsteranern waren Wissenschaftler vom College of Life Sciences, Northwest A&F University in Shaanxi und vom Biotechnology Research Institute, Chinese Academy of Agricultural Sciences in Peking (China) sowie von der Martin-Luther-Universität Halle-Wittenberg beteiligt.
Förderung
Die Arbeit erhielt finanzielle Unterstützung durch die National Natural Science Foundation of China (NSFC) und die Deutsche Forschungsgemeinschaft (DFG).
Originalpublikation
Dali Fu et al. (2022): Ca2+-dependent phosphorylation of NRAMP1 by CPK21 and CPK23 facilitates manganese uptake and homeostasis in Arabidopsis. Proc Natl Acad Sci USA 119(40); doi: 10.1073/pnas.2204574119. Epub 2022 Sep 26.
