
Tausende Proteinschalter ermöglichen Pflanzen den Wechsel vom Dunkel ins Licht
Bereits in der Schule lernt man, dass bei Lichteinstrahlung Pflanzen in ihren Chloroplasten Fotosynthese betreiben. Bei Dunkelheit kommt dieser Prozess zum Erliegen. Stattdessen aktivieren grüne Pflanzengewebe wie beispielsweise Blätter dann die Zellatmung, bei der sie Kohlenhydrate und Sauerstoff in den Mitochondrien verbrauchen, ähnlich wie Menschen das ständig tun. Diese beiden Prozesse – Fotosynthese und Zellatmung – finden in Pflanzenzellen sowohl räumlich als auch zeitlich voneinander getrennt statt. Die grundlegende Umstellung ihres Stoffwechsels ist eine Meisterleistung, die Pflanzen fast unbemerkt im täglichen Licht-Dunkel Wechsel in kürzester Zeit vollziehen.
Was dabei in der Pflanze auf molekularer Ebene genau passiert, beschäftigt Wissenschaftler bereits seit Jahrzehnten. Allerdings fokussierten sich die meisten Studien bisher auf die Regulation einzelner Proteine. Ein Forschungsteam um Prof. Dr. Iris Finkemeier vom Institut für Biologie und Biotechnologie der Pflanzen an der Universität Münster hat nun eine Studie veröffentlicht, die die zentrale Reprogrammierung auf Ebene der Proteine in bisher nicht da gewesener Detailschärfe analysiert. Die Forscherinnen und Forscher analysierten Blattgewebe von Pflanzen beim Wechsel von Dunkelheit zum Licht. Ergebnis: Innerhalb von nur 15 Minuten nach dem Wechsel ins Licht ist die Fotosynthese voll aktiv. Die Pflanze stellt dabei nicht ihr gesamtes Inventar an Proteinen neu her, sondern nimmt gezielt biochemische Veränderungen an den bereits vorhandenen Proteinen vor, sogenannte posttranslationale Modifikationen (PTM). Diese PTM können wiederum die Aktivität von Enzymen steuern und so die Funktion der Zelle rasch und grundlegend umstellen. Die Studienergebnisse sind jetzt in der Fachzeitschrift „The Plant Journal“ erschienen.
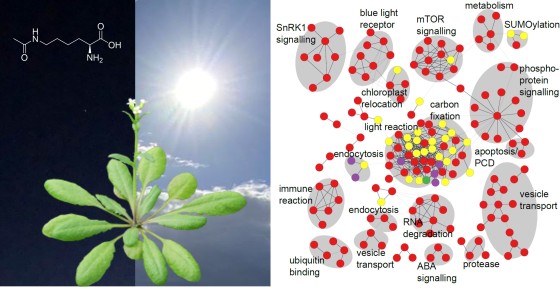
In bisherigen Studien untersuchten die Wissenschaftler nur einzelne PTM, wie beispielsweise die Phosphorylierung, und betrachteten oft nur ausgewählte Proteine. „Wir haben uns diese Prozesse für das gesamte Proteininventar angeschaut und dazu erstmals drei der wichtigsten Modifikationen untersucht, die die Proteinfunktionen steuern: Phosphorylierung, Lysin-Acetylierung und Cystein-basierte Redox-Schalter. Unsere Ergebnisse stellen einen Atlas der Proteinmodifikationen im Dunkel-Licht-Wechsel der Modellpflanze Arabidopsis thaliana dar – besser bekannt als Acker-Schmalwand. Andere Forscher können in unserem Datensatz nach einem bestimmten Protein suchen und prüfen, ob es im Dunkel-Licht-Wechsel chemisch verändert wird mit möglichen Folgen für seine Funktion“, erklärt Iris Finkemeier. Von den über 24.000 nachgewiesenen posttranslationalen Proteinmodifikationen wurden mehr als 1.700 während des Übergangs von Dunkelheit zu Licht verändert.
Neben physiologischen Methoden zur Messung der Fotosyntheseleistung und der Metabolitzusammensetzung verwendete das Team hochauflösende Proteinmassenspektrometrie, um mehrere tausend Proteine gleichzeitig zu betrachten. Mithilfe der Massenspektrometrie bestimmen die Biotechnologen die exakte Masse von komplexen Molekülen. Wenn das Molekül eine chemische Modifikation trägt, hat es ein anderes Gewicht als ein Molekül ohne die Modifikation. „Wir können die exakte Masse mit einer Abweichung von nur einem Milligramm pro Kilogramm bestimmen. Das ist so, als würde man alle Einwohner einer Kleinstadt wiegen und zwar jeweils auf das Zehntelgramm genau“, erläutert Dr. Jürgen Eirich, Koautor der Studie. Die ersten Änderungen konnten bereits nach fünf Minuten im Licht beobachtet werden, wobei zu diesem Zeitpunkt noch die meisten Veränderungen an den Proteinen in den Chloroplasten stattfanden, also dort, wo der Start der Fotosynthese primär zu einer Veränderung der Zellfunktion führt. Diese Veränderungen bleiben jedoch nicht auf die Chloroplasten beschränkt. Nach 30 Minuten ist die gesamte Zelle von diversen Veränderungen an den Proteinen betroffen.
Die Studienergebnisse sind insbesondere für Biologen, Biotechnologen und Pflanzenzüchtern von Bedeutung. Sie bieten eine reichhaltige Ausgangsbasis, um den Stoffwechsel von Pflanzen an den entscheidenden Stellen zu verändern oder Stoffwechselwege an- oder abzuschalten, um Wachstum, Ertrag oder Widerstandsfähigkeit von Pflanzen zu verbessern. An der Arbeit waren auch Wissenschaftler der Universität Bonn und des Max-Planck-Instituts für molekulare Pflanzenphysiologie in Golm beteiligt. Die Arbeit erhielt finanzielle Unterstützung von der Deutschen Forschungsgemeinschaft.
Originalpublikation
Giese, J. et al (2023). The interplay of posttranslational protein modifications in Arabidopsis leaves during photosynthesis induction. The Plant Journal. DOI: 10.1111/tpj.16406
