
Chemiker entwickeln neuen Ansatz in der Krebsforschung
Gerät die Regulation von Zellwachstum und -teilung außer Kontrolle, ist Krebs eine mögliche Folge. Das Gen „MYC“ spielt beispielsweise bei Menschen eine wichtige Rolle bei der Steuerung des Zellwachstums. Funktioniert es nicht mehr richtig, wachsen Zellen unkontrolliert. Daher nennt man dieses wachstumsfördernde Gen auch „Krebsgen“. Ein amerikanisch-deutsches Forscherteam beschreibt nun in der Fachzeitschrift „Nature“ einen neuen Ansatz, um über eine gezielte Veränderung der RNA das MYC-Gen auszuschalten. Unter den Wissenschaftlern ist Prof. Dr. Frank Glorius vom Organisch-Chemischen Institut der WWU Münster.
Der Ansatz der Wissenschaftler lenkt zersetzende Enzyme der Zellen auf die RNA der „Krebsgene“ und schneidet Schlüsselsegmente ab. Dadurch werden die Gene inaktiviert und daran gehindert, Schaden anzurichten. Die Wirkung entsteht dadurch, dass die Forscher in der Zelle vorkommende Enzyme mit einem weiteren molekularen Element verbinden. Diese Verbindung, RIBOTAC genannt, funktionierte gegen MYC und auch gegen zwei andere „Krebsgene“, JUN und MIR155. Alle drei regulieren die Transkription anderer Gene. Versuche, Medikamente zu entwickeln, die diese drei Onkogene daran hindern, Schaden anzurichten, sind aufgrund ihrer komplexen strukturellen Herausforderungen bislang weitgehend gescheitert.
Für die Forscher ist die Methode ein vielversprechender Ansatz für eine mögliche neue Krebstherapie. So sagt Prof. Dr. Herbert Waldmann, Direktor des Max-Planck-Instituts für molekulare Physiologie in Dortmund: „Für Krebspatienten, deren Krankheit von diesen häufigen, aber herausfordernden Onkogenen angetrieben wird, könnte der RNA-Degrader-Ansatz neue Hoffnung bieten.“ Zum jetzigen Zeitpunkt, so betonen die Forscher, handele es sich jedoch um Grundlagenforschung und um keine fertige Behandlungsmethode.
Die Studie eröffne zudem neue Möglichkeiten für den gezielten Einsatz von Medikamenten gegen RNA, sodass möglicherweise auch andere genetische Erkrankungen für diesen Behandlungsansatz in Frage kommen, sagt der Chemiker und Institutsprofessor Dr. Matthew D. Disney vom Herbert Wertheim UF Scripps Institute for Biomedical Innovation & Technology und dem UF Health Cancer Center, USA. „Wir haben rund 2.000 neue RNA-Strukturen entdeckt, die arzneimittelähnliche kleine Moleküle binden können, und sechs neue Chemotypen identifiziert, die RNA binden können“, betont Matthew Disney, der die Studie leitete.
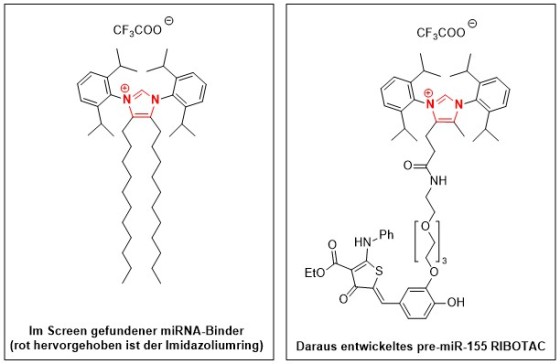
Zum Hintergrund: Herbert Waldmanns Gruppe entwirft Verbindungen, die von natürlichen Substanzen inspiriert sind. Aus solchen Substanzen gingen bereits viele Antibiotika und Krebsmedikamente hervor. Frank Glorius hat innovative Methoden zum Aufbau neuer bioaktiver Moleküle entwickelt. Einige seiner Verbindungen wurden speziell entwickelt, um die Biologie in Zellmembranen zu beeinflussen. Verbindungen, die von Imidazol abgeleitet sind und die mit Kohlenstoffketten modifiziert wurden, erwiesen sich schließlich als am wirksamsten bei der Bindung an die mit Krebs assoziierten RNAs. Imidazol ist ein Molekül, das in Naturprodukten und Arzneimitteln häufig vorkommt.
Für die Studie wurden unter anderem Untersuchungen an Krebszellkulturen durchgeführt sowie an Mäusen zur Bewertung der Lungenbesiedlung durch Brustkrebszellen.
Originalveröffentlichung
Tong, Y., Lee, Y., Liu, X. et al. Programming inactive RNA-binding small molecules into bioactive degraders. Nature (2023). DOI: 10.1038/s41586-023-06091-8
