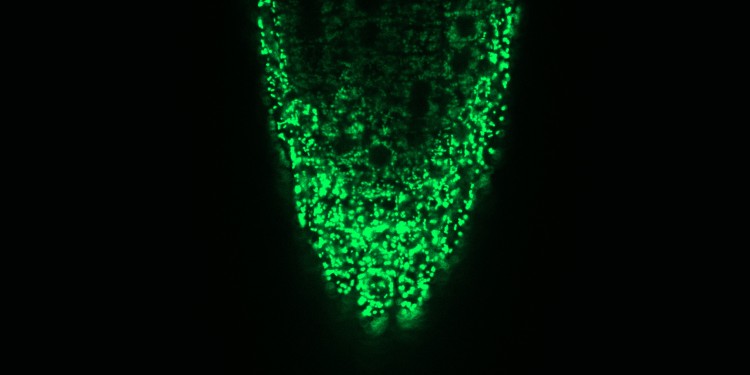
Forscher entschlüsseln Weg von Kalziumionen in Pflanzenzellen
Kalzium ist ein besonderer Mineralstoff – beispielsweise übertragen Kalziumionen in den Zellen der meisten Lebewesen als sogenannte Second Messenger wichtige Signale. Dies gilt gleichermaßen für tierische, pflanzliche und pilzliche Zellen. Mitglieder der Arbeitsgruppe „Plant Energie Biology“ unter der Leitung von Prof. Dr. Markus Schwarzländer an der Westfälischen Wilhelms-Universität (WWU) Münster und der Arbeitsgruppe von Prof. Dr. Alex Costa an der Universität Mailand wiesen mit Hilfe weiterer nationaler und internationaler Forschungseinrichtungen nun erstmals nach, über welche molekulare Maschinerie Kalziumionen in die Mitochondrien von Pflanzenzellen aufgenommen werden. Dieser Aufnahmeweg spielt für die Pflanze eine wichtige Rolle bei ihrer Berührungsempfindung. Die Studie ist jetzt in der Fachzeitschrift „The Plant Cell“ erschienen.
Der Weg der Kalziumionen in die Mitochondrien
„Es ist verblüffend, dass ein so einfaches Ion derart wichtig ist für die Informationsübertragung. Wir gehen davon aus, dass die Kalziumionen dieses Potenzial durch den Ort und die Zeit ihres Einsatzes entfalten“, erklärt Markus Schwarzländer. Bereits seit 1965 ist bekannt, dass Pflanzenmitochondrien Kalzium aufnehmen können und sich so mutmaßlich an Kalziumsignalwegen beteiligen. Wie genau die Aufnahme vermittelt wird, war jedoch jahrzehntelang umstritten. Für die meisten Ionen ist die innere Mitochondrienmembran undurchlässig, bestimmte Membranproteine können aber dafür sorgen, dass die Kalziumionen diese teildurchlässige Membran durchdringen und so die Signalübertragung in diesem Zellorganell ermöglichen.
Für Tiere wurde die Frage nach der Identität des mitochondriellen Kalziumkanals 2011 beantwortet, als Wissenschaftler der Universitäten Harvard (USA) und Padua (Italien) den Kalziumkanal MCU (mitochondrial calcium uniporter) entdeckten. Dieser Durchbruch ebnete den Weg für die Erkenntnis, dass Pflanzen ebenso MCU-Gene in ihrem Erbgut enthalten. Unklar blieb allerdings, ob diese Gene in der lebenden Zelle ebenfalls Kalziumionenkanäle bilden – nicht zuletzt, weil die Kalziumionenaufnahme bei Tieren deutlich andere Muster aufweist als die der Pflanzen.
Gensteuerung offenbart die Bedeutung der Kalziumionenaufnahme für die Zellkraftwerke
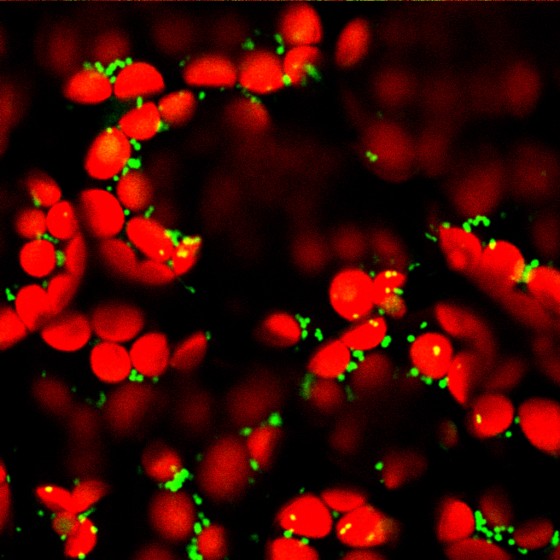
Nach dieser Beobachtung versuchte das Team mithilfe der Pflanzen, die in ihrer mitochondriellen Kalziumaufnahme gestört waren, herauszufinden, welche Rolle mitochondrielles Kalzium für die Pflanze und ihre Fitness hat. In Tieren regulieren Kalziumionen in den Mitochondrien die Energieproduktion, in Pflanzen gab es dafür bislang keine Hinweise.
Die Forscher konnten jetzt durch eine Analyse der Expression des gesamten Pflanzengenoms nachweisen, dass sich die verringerte Transportkapazität für Kalziumionen auf die Regulation des pflanzlichen Hormons Jasmonsäure auswirkt. Jasmonsäure ist ein Abwehrhormon in Pflanzen, das vor Fressfeinden schützt, indem es bei Verletzungen aktiviert wird. Auch die Seneszenz, also das regulierte Absterben von Gewebe, und die Antwort auf mechanische Reize wie Berührungen werden unter anderem von der Jasmonsäure kontrolliert. Die von den Forschern manipulierten Pflanzen zeigten eine leicht verzögerte Seneszenz: In dunkler Umgebung verloren die Blätter weniger schnell ihr Blattgrün. Zudem wiesen sie eine deutlich abgeschwächte Antwort auf Berührung auf. „Besonders überraschend für uns ist, dass es offenbar eine Verbindung zwischen der Kalziumionenaufnahme in die Mitochondrien und der Jasmonsäure-Regulation gibt. Die Ergebnisse zeigen, dass molekulare Prozesse wie die Kalziumionenaufnahme in die Mitochondrien, die in Tieren und Pflanzen über die Evolution erhalten wurden, in den Dienst unterschiedlicher Funktionen gestellt werden können“, erläutert Markus Schwarzländer. Auch erscheint die gezielte Umprogrammierung von mitochondrieller Kalziumaufnahme als interessante Aufgabe, da eine kontrollierte Berührungsantwort beispielsweise in der Landwirtschaft, wo Pflanzen oft dicht beisammen gepflanzt werden, von Nutzen sein könnte.
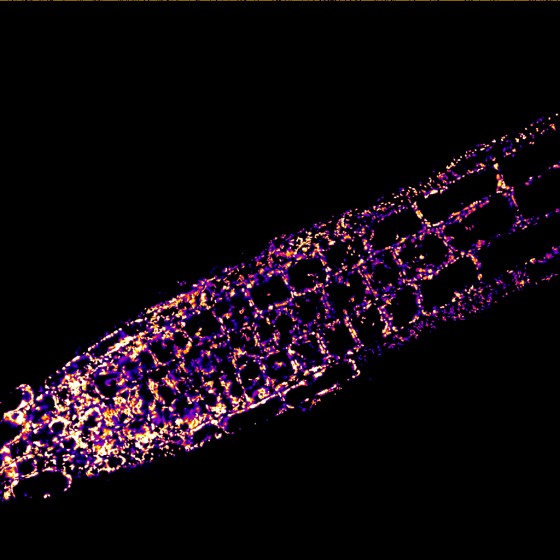
Den Kern der Studie bilden die Arbeitsgruppen von Markus Schwarzländer und Alex Costa zu gleichen Teilen. Die Erstautorin Dr. Cristina Ruberti hatte zunächst für zwei Jahre in Münster geforscht, ehe sie an die Università degli Studi in Mailand wechselte. Zu den Partnern gehören zudem Arbeitsgruppen aus Halle, Heidelberg, Bonn, Lund (Schweden), Antwerpen (Belgien) und Viçosa (Brasilien).
Originalpublikation
Cristina Ruberti, Alex Costa, Markus Schwarzländer et. al.: MCU proteins dominate in vivo mitochondrial Ca2+ uptake in Arabidopsis roots. The Plant Cell (2022); DOI: 10.1093/plcell/koac242
