"Hand in Hand in Hand": Drei Katalysatoren lösen chemisches Problem
Für die organische Synthese, also für die Herstellung von Kohlenstoff-Verbindungen, ist die Entwicklung von Syntheseverfahren von Bedeutung, durch die sich das gewünschte Produkt in guter Ausbeute gewinnen lässt. Gleichzeitig sollen die Verfahren nachhaltig sein: Sie sollen beispielsweise umweltfreundliche und leicht verfügbare Reagenzien verwenden, wenig Abfall erzeugen und wenig Energie verbrauchen. Neue Syntheseverfahren, die diese Kriterien erfüllen, können als Sprungbrett für Innovationen dienen – von der medizinischen Chemie bis zur Materialwissenschaft. Ein Beispiel sind sogenannte Übergangsmetall-katalysierte Kreuzkupplungsreaktionen. Auf diesem Gebiet hat ein Forschungsteam unter der Leitung der Chemieprofessoren Frank Glorius (Universität Münster) und Kendall N. Houk (University of California, Los Angeles) jetzt ein Problem gelöst, das seit Jahren als Herausforderung galt: die katalytische Kohlenstoff-Wasserstoff- (C-H-) Arylierung von unaktivierten Alkenen. Dazu setzten sie ein System aus drei Katalysatoren ein. Die Studie wurde in der Eröffnungsausgabe der neu gegründeten Zeitschrift "Nature Synthesis" veröffentlicht.
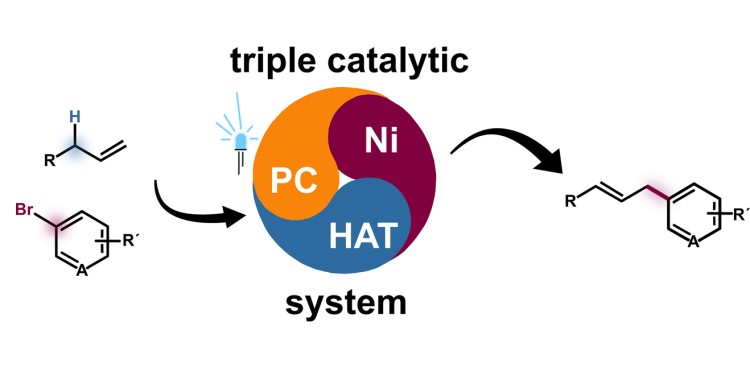
Unaktivierte (reaktionsträge) Alkene sind aufgrund ihrer guten Verfügbarkeit als Ausgangschemikalien für Reaktionsprozesse bekannt. Über eine Arylierung, also das Einfügen einer Arylgruppe, können die Eigenschaften der Verbindung gezielt verändert werden. In der aktuellen Arbeit ist es den Forschern gelungen, eine spezielle funktionelle Gruppe – eine Arylgruppe – über eine Katalyse direkt einzufügen, ohne mehrstufige Synthese. Als Katalyse bezeichnen Chemiker die Beschleunigung und Steuerung von chemischen Reaktionen. Für die meisten Katalyse-Reaktionen benötigt man nur einen Katalysator. „In unserem Fall arbeiten jedoch drei Katalysatoren zusammen (‚ternäre Katalyse‘). Dies ist besonders anspruchsvoll, wie das Jonglieren mit mehreren Bällen“, unterstreicht Frank Glorius. „Die drei Katalysatoren arbeiten quasi Hand in Hand in Hand.“ Einer der Katalysatoren ist ein Photokatalysator, der Energie aus Licht für die Reaktion verfügbar macht. Das gesamte Katalysatorsystem ist ein sogenanntes ternäres Nickel-Wasserstoffatomtransfer-Photodox-Synergiesystem.
„Unsere redoxneutrale photochemische Strategie ist gut anwendbar. Wir können damit Verbindungen mit vielen verschiedenen Eigenschaften erzeugen. Chemiker sprechen von einer hohen Funktionsgruppentoleranz und Anwendungsbreite“, erläutert Frank Glorius. „Wir können damit Arzneimittel- und Naturproduktderivate selektiv an der Allylposition arylieren. Damit könnte man die Wirksamkeit verbessern oder ganz neue Anwendungsmöglichkeiten eröffnen.“
Ken Houk ergänzt: „In der Regel sind Kohlenstoff-Wasserstoff-Bindungen reaktionsträge. Die Verwendung der ternären Katalyse ermöglicht es uns, selektiv eine Kohlenstoff-Wasserstoff-Bindung für die Reaktion zu nutzen und sie mit dem gewünschten Partner zu verknüpfen.“
Zusätzlich zu den synthetischen Möglichkeiten der Methode hat das Team die mechanistischen Feinheiten dieser ternären Verbindung untersucht. Durch die Kombination von experimentellen Beobachtungen mit Dichtefunktionaltheorie-Berechnungen haben die Wissenschaftler ein realistisches Bild der elementaren Schritte gezeichnet, die an dem Prozess beteiligt sind.
Zum Hintergrund: Die Eigenschaften organischer Verbindungen werden maßgeblich von sogenannten funktionellen Gruppen bestimmt, die an einem Gerüst aus Kohlenstoff-Atomen sitzen. Um neue Moleküle herzustellen, werden funktionelle Gruppen ineinander umgewandelt. Häufig sind hierfür mehrstufige Synthesen nötig. Günstiger ist es, auf die funktionelle Gruppe zu verzichten und stattdessen das gewünschte Produkt direkt aus einer Kohlenstoff-Wasserstoff-Bindung herzustellen („C-H-Funktionalisierung“). Allerdings stehen Chemiker dabei vor großen Herausforderungen, was die Auswahl geeigneter Ausgangsverbindungen und Synthesestrategien angeht.
Finanzierung
Diese Arbeit erhielt finanzielle Unterstützung von der Alexander von Humboldt-Stiftung, der Deutschen Forschungsgemeinschaft (Leibniz-Preis, SBF 858), der National Science Foundation (CHE-1764328) und der Zhejiang University, China.
Originalveröffentlichung
Huan-Ming Huang, Peter Bellotti, Pan-Pan Chen, Kendall N. Houk and Frank Glorius: Allylic C(sp3)-H arylation of olefins via ternary catalysis. Nature Synthesis 1, 59–68 (2022), DOI: 10.1038/s44160-021-00006-z
