Eine neue Art bioinspirierter Wirkstofftransporter
Mit Nanocontainern lassen sich Substanzen gezielt in das Innere von Zellen transportieren, wo sie dann ihre Wirkung entfalten können. Diese Methode kommt beispielsweise bei den aktuell verwendeten mRNA-Impfstoffen gegen Covid-19 und bestimmten Krebsmedikamenten zum Einsatz. In der Forschung können solche Wirkstofftransporter zudem dazu dienen, markierte Substanzen in Zellen einzuschleusen und damit grundlegende zelluläre Funktionen zu untersuchen. Um ihr Potenzial nutzen zu können, wird intensiv daran geforscht, wie Nanocontainer mit biologischen Umgebungen interagieren und wie sie chemisch so aufgebaut werden können, dass sie Substanzen möglichst schonend und kontrolliert in die Zellen bringen.
Wissenschaftler der Westfälischen Wilhelms-Universität Münster (WWU) haben jetzt eine neue Art von Nanocontainern entwickelt, die vollständig aus biologischen Bestandteilen aufgebaut sind. Anders als andere Wirkstofftransporter basieren sie nicht auf Lipiden, also Fetten, sondern auf Zuckerverbindungen und werden von einer in ihrer Dicke genau abgestimmten Schicht aus Eiweißstrukturen – sogenannten Polypeptiden – abgedichtet. „Wir stellen die Komponenten unserer Nanocontainer zwar synthetisch her, sie werden aber genau wie natürlich vorkommende Stoffe von Zellen aufgenommen und – aufgrund der von uns entwickelten Gesamtstruktur – auch abgebaut“, erklärt der Chemiker Prof. Dr. Bart Jan Ravoo. „Für den Abbau der Containerhülle im Inneren der Zelle nutzen wir gleich zwei natürliche Mechanismen aus – dadurch werden die transportierten Stoffe zügig freigesetzt, sobald sie in der Zelle angekommen sind“, ergänzt der Biochemiker Prof. Dr. Volker Gerke.
Die Wissenschaftler wollen die winzigen Nanocontainer mit einem Durchmesser von etwa 150 Nanometern nutzen, um markierte biologisch relevante Lipide in Zellen einzubringen und damit Transportprozesse in der Zellmembran zu untersuchen. Darüber hinaus möchten sie das chemische Design der Container weiterentwickeln, damit diese beispielsweise nur von bestimmten Zellarten aufgenommen werden oder um das Freisetzen der Ladung von außen durch Licht steuern zu können. Perspektivisch könnten sich aus Zucker- und Eiweißkomponenten aufgebaute Transportsysteme auch für Anwendungen in lebenden Organismen eignen, um Medikamente gezielt an die Orte zu bringen, an denen sie gebraucht werden. Die Studie ist in der Fachzeitschrift „Advanced Science“ erschienen.
Details zu Methoden und Ergebnissen
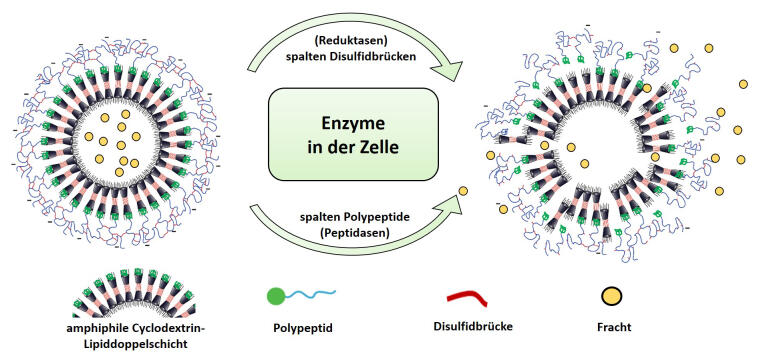
Bioinspirierte Materialien organisieren sich zu beladenen Containern
Um die neuen Wirkstofftransporter herzustellen, verwendeten die Wissenschaftler Zuckerverbindungen (modifizierte Cyclodextrine), die in ihrer Struktur – und dadurch auch in ihrem Verhalten – Lipiden ähneln, die natürlicherweise in jeder Zelle vorkommen. Wie die schützenden Zellmembranlipide ordnen sich die Zuckerstrukturen von selbst so an, dass sie eine Hülle formen, in die sie die zu transportierenden Substanzen einschließen. Da der entstehende Container allerdings noch undicht ist und seine Ladung mit der Zeit verlieren würde, fügten die Wissenschaftler Eiweißstrukturen (Polypeptide) hinzu, die eine Schutzschicht um den Container bilden. „Um zu testen, wie dick die Schutzschicht sein muss, haben wir die Länge der Peptidsequenzen variiert und sie so zugeschnitten, dass die Container ihre Fracht stabil einkapseln“, erklärt Sharafudheen Pottanam Chali, Chemiedoktorand und einer der beiden Erstautoren der Studie.
Nanocontainer nutzen einen natürlichen Weg in die Zellen
Im nächsten Schritt untersuchten die Wissenschaftler, ob und wie die neu entwickelten Nanocontainer von Zellen aufgenommen werden. Ihre Hypothese war, dass dies über die sogenannte Endozytose geschieht. Dabei stülpen die Zellen einen Teil ihrer Zellmembran nach innen und schnüren ihn ab, so dass kleine Bläschen entstehen – die Endosomen – in denen das außerzelluläre Material in die Zelle transportiert wird. Um dies zu überprüfen, nutzten die Wissenschaftler eine Zuckerverbindung (Dextran), von der bekannt ist, dass sie durch die Endosomen aufgenommen wird. Sie gaben rot fluoreszierendes Dextran sowie Nanocontainer, die sie mit einer grün fluoreszierenden Ladung (Pyranin) befüllten, in eine Zellkultur. „Am Fluoreszenzmikroskop wurde sichtbar, dass beide Stoffe auf gleiche Art in die Zellen aufgenommen wurden und ihre Fluoreszenz sich dort überlagerte – daraus konnten wir schließen, dass die Nanocontainer genau wie das Dextran von den Zellen effizient durch den endosomalen Transportvorgang aufgenommen wurden“, erklärt Sergej Kudruk, Biochemiedoktorand und ebenfalls Erstautor der Studie. Die Wissenschaftler überprüften dies für zwei verschiedene Zellarten – menschliche Blutgefäßzellen und Krebszellen.
Containerhülle wird durch Enzyme in den Endosomen der Zellen abgebaut
Im Inneren der Endosomen herrschen Bedingungen, die sich von der Zellumgebung unterscheiden. Dies hatten die Wissenschaftler bei der Konzeption ihrer Nanocontainer bereits im Blick und bauten sie so auf, dass das veränderte Milieu in den Endosomen die Polypeptidhülle destabilisiert und partiell abbaut – die Nanocontainer werden somit undicht und entlassen ihre Ladung in das Innere der Zelle. „Beim Abbau der Containerhülle wirken zwei Typen von Enzymen, von denen wir wussten, dass sie in Endosomen vorkommen, und die sich an spezifischen Stellen am Abbau der Hülle beteiligen können“, erklärt Sergej Kudruk. „Sogenannte Reduktasen bauen die Disulfidbrücken ab, die vorher aufgebaut wurden und die Peptidmoleküle unseres Nanocontainers kreuzvernetzen – zusätzlich spalten Peptidasen die Peptidmoleküle selbst“, ergänzt Sharafudheen Pottanam Chali. Die Wissenschaftler überprüften die Abbaubarkeit der Containerhülle auch außerhalb der Zelle. Dazu beluden sie die Container mit einem fluoreszierenden Farbstoff und simulierten einen Teil der komplexen endosomalen Mikroumgebung, indem sie das Enzym Trypsin sowie Reduktionsmittel einsetzten. Nach der Behandlung trat der Farbstoff unverkennbar aus.
Förderung
Die Studie wurde von der Deutschen Forschungsgemeinschaft gefördert, insbesondere im Rahmen des Sonderforschungsbereichs 858 „Synergetische Effekte in der Chemie – von der Additivität zur Kooperativität“ der WWU. Darüber hinaus wurde sie durch das Cells in Motion Interfaculty Centre der WWU unterstützt.
Originalpublikation
Kudruk S°, Pottanam Chali S°, Linard Matos AL, Bourque C, Dunker C, Gatsogiannis C, Ravoo BJ*, Gerke V*. Biodegradable and Dual-Responsive Polypeptide-Shelled Cyclodextrin-Containers for Intracellular Delivery of Membrane-Impermeable Cargo. Adv Sci (Weinh). 2021 Jul 18;e2100694. doi: 10.1002/advs.202100694 (°*authors contributed equally)
Links
- Originalpublikation in „Advanced Science“
- Forschungsgruppe Prof. Dr. Volker Gerke an der Universität Münster
- Forschungsgruppe Prof. Dr. Bart Jan Ravoo an der Universität Münster [en]
- Forschungsschwerpunkt „Zelldynamik und Bildgebung“ an der WWU
- Forschungsschwerpunkt „Nanowissenschaften“ an der WWU
Autorin: Doris Niederhoff

