B-Zellen des Immunsystems in der Hirnhaut entdeckt
Das Gehirn birgt für die Medizin zahlreiche ungelöste Rätsel. Erst vor wenigen Jahren wurde entdeckt, dass die äußere Schicht der Hirnhäute von Lymphgefäßen durchzogen ist. Von diesen Gefäßen ist bekannt, dass sie Immunzellen transportieren – die weißen Blutkörperchen. Dadurch rückte zunehmend in den Fokus, dass die Hirnhäute unerwartet viele dieser Zellen enthalten, die zum körpereigenen Abwehrsystem gehören. Der aus Hirnhäuten und Nervenwasser bestehende Gewebesack, in dem Gehirn und Rückenmark sozusagen „schwimmen“, schützt das Gehirn somit vermutlich nicht nur vor äußeren Einwirkungen wie Erschütterungen, sondern spielt wahrscheinlich auch eine wichtige Rolle bei Entzündungen des Gehirns. Wissenschaftlerinnen und Wissenschaftler der Westfälischen Wilhelms-Universität (WWU) Münster haben jetzt systematisch untersucht, welche Immunzellen die Hirnhäute und das Nervenwasser im gesunden Zustand genau bevölkern.
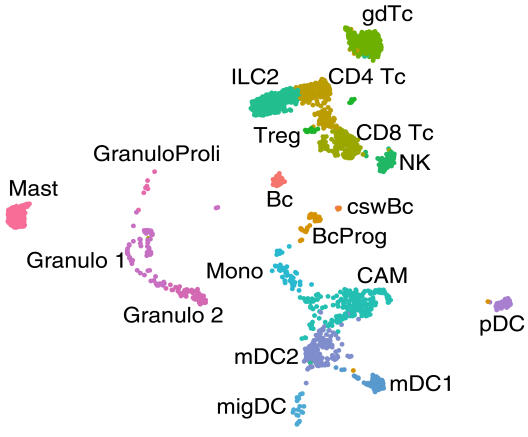
„Wir haben das Hirngewebe systematisch nach Immunzellen abgesucht und analysiert, welche Zelltypen in welcher Menge in den unterschiedlichen Gewebebestandteilen vorhanden sind“, erklärt Dr. Gerd Meyer zu Hörste, Neurologe und Leiter der Studie. Da menschliche Proben von gesundem Hirngewebe nicht in ausreichender Menge verfügbar sind, um bei einem solchen Screening statistisch aussagekräftige Ergebnisse zu erhalten, arbeiteten die Wissenschaftler zunächst mit Gewebe von Mäusen und Ratten. Sie fanden heraus, dass verschiedene Arten weißer Blutkörperchen – die T- und B-Zellen, natürliche Killerzellen, Fresszellen und Granulozyten sowie deren Subtypen – in den Hirnhäuten und im Nervenwasser in jeweils unterschiedlichen und ganz spezifischen Zusammensetzungen vorkommen. Sie zeigten auch, dass in den gleichen Zelltypen unterschiedliche Gene aktiv sind, je nachdem, in welchem Gewebe sie sich befinden – was bedeutet, dass die Zellen dort offensichtlich unterschiedliche Funktionen erfüllen. Für die Wissenschaftler unerwartet war, dass sie in der äußeren Hirnhautschicht – der Dura mater, kurz Dura – eine große Anzahl von B-Zellen und deren noch nicht ausgereifte Vorläufer fanden. Diese Erkenntnis konnten sie in zielgerichteten Untersuchungen auch in menschlichem Gewebe bestätigen. „Dass sich dieser Zelltyp in der Dura ansiedelt und entwickelt, spricht dafür, dass er dort eine spezielle Funktion des Immunsystems erfüllt,“ sagt Gerd Meyer zu Hörste. Wenn weitere Untersuchungen zeigen würden, bei welchen Erkrankungen und in welcher Form dies der Fall sei, könnten diese Zellen möglicherweise einen neuen Angriffspunkt bieten, diese Erkrankungen zu bekämpfen.
Die aktiven Gene in jeder einzelnen Immunzelle erfassen
Um die Immunzellen im Gewebe zu identifizieren, markierten die Wissenschaftler mithilfe eines Antikörpers bestimmte Proteine, die auf der Oberfläche aller Immunzellen vorkommen. Für ihre Untersuchungen isolierten sie dann möglichst viele Immunzellen aus dem Gewebe und analysierten diese mit einer speziellen Methode: der RNA-Sequenzierung auf Einzelzellebene, mit der sich messen lässt, welche Gene in jeder einzelnen Zelle einer Probe aktiv sind. RNA (Ribonukleinsäure, aus dem Englischen „ribonucleic acid“) ist eine Kopie der genetischen Informationen, die in der DNA im Zellkern gespeichert sind, und transportiert diese aus dem Zellkern ins Zellplasma. Dort dient die RNA als Anleitung zur Herstellung von Proteinen. Proteine wiederum ermöglichen als Arbeiter der Zelle spezifische Funktionen verschiedener Zelltypen. An der RNA lässt sich also ablesen, welche Gene einer Zelle aktiv sind – im Fachjargon Genexpression – und welche Eigenschaften die Zelle somit hat. Computergestützt lassen sich die einzelnen Zellen eines Gewebes dann nach Ähnlichkeit sortieren und in unterschiedliche Zelltypen einteilen.
„Diese Analyse auf Einzelzellebene hat im Vergleich zur konventionellen RNA-Sequenzierung und anderen Methoden entscheidende Vorteile“, erklärt der Biologiedoktorand David Schafflick. „Mit den anderen Methoden analysiert man immer eine Mischung von Genen mehrerer Zellen und muss die zu analysierenden Gene teilweise vorher schon kennen.“ Man könne sich dies vorstellen, wie den Versuch, die genaue Zusammensetzung eines Smoothies herauszuschmecken: Aus einem Schluck Smoothie alle Bestandteile herauszuschmecken, ist schwer, und man kann nur Zutaten herausschmecken, die man kennt. Genau zu bestimmen, in welcher Menge diese enthalten sind, ist kaum möglich. Die Wissenschaftler schauten sich deshalb sozusagen nicht den fertig gemischten Smoothie an, sondern den Korb voller Früchte – sprich jede einzelne Zelle. „Nur so war es überhaupt möglich, die B-Zell-Vorläufer in der Dura zu finden, denn mit diesem Zelltyp hätte man außerhalb des Knochenmarks nicht gerechnet,“ berichtet David Schafflick.
B-Zellen und ihre Vorläufer besiedeln die äußere Hirnhautschicht
B-Zellen sind eine Unterklasse der weißen Blutkörperchen, die Antikörper produzieren, damit Krankheitserreger bekämpfen und Entzündungsreaktionen des Körpers vorantreiben. Die Wissenschaftler entdeckten, dass in der äußeren Hirnhautschicht deutlich mehr dieser Zellen vorkommen als in den anderen Geweben. In Zeitverlaufsanalysen zeigte sich, dass sich die Zellen ungewöhnlicherweise lange im Gewebe aufhielten und dass sie nicht – wie sonst für Immunzellen typisch – im Blutkreislauf patrouillierten. „Noch überraschender war für uns, dass die Hirnhautschicht auch die Vorläufer von B-Zellen enthielt – also noch nicht voll ausgebildete Immunzellen“, erzählt David Schafflick. Die Entwicklung dieser Vorläuferzellen zu funktionstüchtigen Zellen findet normalerweise im Knochenmark statt. Dort entwickeln sie sich aus Stammzellen und wandern dann als voll entwickelte Immunzellen dorthin, wo sie im Körper benötigt werden. „Da wir in der Dura keine Stammzellen finden konnten, müssen die B-Zell-Vorläufer ursprünglich aus dem Knochenmark kommen und dieses verlassen haben, obwohl sie noch nicht voll entwickelt waren“, sagt David Schafflick. Die Wissenschaftler konnten zeigen, dass die Zellen nicht über das Blut in die Dura gelangt sind. Sie vermuten daher, dass die Zellen aus dem Knochenmark des angrenzenden Schädelknochens kommen und auf direktem Weg in die Dura wandern. Außerdem fanden sie dort keine Vorläufer von anderen Immunzelltypen, was dafür spricht, dass dies ein spezieller Mechanismus ist, der nur für B-Zellen gilt. Um zu prüfen, ob die B-Zellen in der Dura grundsätzlich eine Rolle bei entzündlichen Erkrankungen spielen, untersuchten die Wissenschaftler, ob sich diese bei Mäusen mit einer Autoimmunerkrankung verändern. Sie konnten zeigen, dass die Zellen auf Entzündungen des Gehirns reagierten und sich für die Produktion von Antikörpern spezialisierten.
Zwei unabhängige Studien mit ähnlichen Ergebnissen
Das münstersche Forschungsteam veröffentlichte seine Arbeiten in der Fachzeitschrift „Nature Neuroscience“. Nur wenige Wochen vorher – während die Studie vom Verlag bereits für die Veröffentlichung vorbereitet wurde – berichteten Forschende aus den USA in der Fachzeitschrift „Science“ ebenfalls davon, dass sie B-Zellen und deren Vorläufer in der Dura gefunden hatten. „Dass wir unabhängig voneinander und mit kleinen methodischen Unterschieden zu nahezu gleichen Erkenntnissen gekommen sind, zeigt, dass unsere Ergebnisse sehr sicher stimmen und dass es sich lohnt, mit diesem Wissen weiterzuarbeiten“, sagt Gerd Meyer zu Hörste. „Unsere Beobachtungen führen uns zu der Vermutung, dass die B-Zell-Vorläufer sich in der Dura zum Teil unabhängig von denen aus dem Knochenmark vermehren und ein Teil der entwickelten B-Zellen anschließend auch in der Dura verweilt, anstatt sie direkt zu verlassen“, ergänzt er. Die Kollegen in den USA hätten hingegen Anhaltspunkte gefunden, dass diese Zellvorläufer sich grundsätzlich im Knochenmark entwickeln und in der Dura nur einen kurzen „Zwischenstopp“ einlegen, um ihre Entwicklung abzuschließen und sich zu spezialisieren. Welche Hypothese sich bestätige, müssten nun weitere Untersuchungen zeigen.
Förderung
Die Studie wurde insbesondere von der Deutschen Forschungsgemeinschaft gefördert, unter anderem im Rahmen des Heisenberg-Programms sowie des Sonderforschungsbereichs/Transregio „Initiierungs-/Effektormechanismen versus Regulationsmechanismen bei Multipler Sklerose“ der Universitäten Münster, Mainz und München. Zudem erhielt sie finanzielle Unterstützung durch das Interdisziplinäre Zentrum für Klinische Forschung der WWU und durch das Ministerium für Innovation, Wissenschaft und Forschung des Landes Nordrhein-Westfalen über ein NRW-Rückkehrstipendium (2015 - 2020), welches Gerd Meyer zu Hörste ermöglichte, nach Forschungsaufenthalten in den USA an der Universität Münster seine Forschungsgruppe aufzubauen.
Originalpublikation
Schafflick D, Wolbert J, Heming M, Thomas C, Hartlehnert M, Börsch AL, Ricci A, Martín-Salamanca S, Li X, Lu IN, Pawlak M, Minnerup J, Strecker JK, Seidenbecher T, Meuth SG, Hidalgo A, Liesz A, Wiendl H, Meyer zu Hörste G. Single-cell profiling of CNS border compartment leukocytes reveals that B cells and their progenitors reside in non-diseased meninges. Nat Neurosci. 2021; 24: 1225-1234. doi: 10.1038/s41593-021-00880-y
Links
- Originalpublikation des münsterschen Forschungsteams in „Nature Neuroscience“
- Publikation des Forschungsteams aus Washington in „Science“
- Forschungsgruppe PD Dr. Gerd Meyer zu Hörste an der Universität Münster
- Forschungsschwerpunkt „Zelldynamik und Bildgebung“ an der Universität Münster
Autorin: Doris Niederhoff

