Gewebebildung: Wie Zellen Kräfte aufbringen
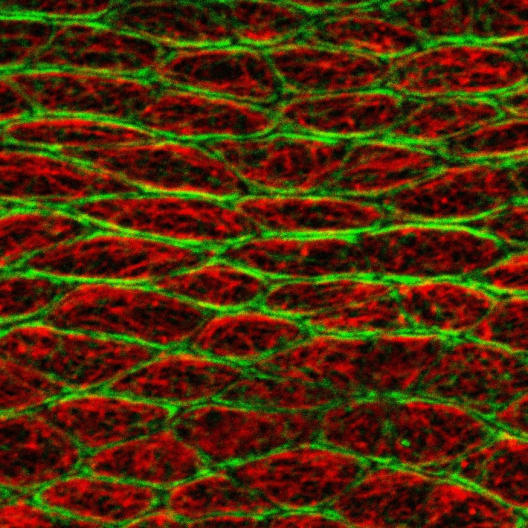
Wenn sich ein Organismus entwickelt, schließen sich Massen von Zellen zusammen und bilden gemeinsam verschiedene Arten von Geweben, die unterschiedliche Funktionen erfüllen. Um sich zu formen und zu bewegen, muss eine Zelle mechanische Kräfte aufbringen. Diese Kräfte entwickelt sie, indem sie ihr sogenanntes Zellskelett umstrukturiert, das sich aus verschiedenen Fasern zusammensetzt. Fasern aus dem Protein Aktin ziehen sich zum Beispiel zusammen und dehnen sich wieder aus. Über mechanische Kräfte, die durch andere Bestandteile des Zellskeletts hervorgerufen werden, ist bisher allerdings nur wenig bekannt. Um das zu ändern, haben sich Wissenschaftler aus Münster und München die Mikrotubuli – das sind röhrenförmige Fasern des Zellskeletts – genauer angesehen. Mithilfe von genetischen, chemischen und mikroskopischen Methoden konnten sie erstmals im lebenden Organismus zeigen, dass Mikrotubuli eine zentrale Rolle für die Mechanik von Zellen spielen. Die Wissenschaftler fanden außerdem mehr über die dahinter liegenden molekularen Mechanismen heraus. „Unsere Ergebnisse zeigen, wie Mikrotubuli dazu beitragen, dass sich mehrere Zellen im entstehenden Gewebe gemeinsam organisieren“, sagt Biologin Dr. Maja Matis, Gruppenleiterin am Exzellenzcluster „Cells in Motion“ der Westfälischen Wilhelms-Universität Münster (WWU) und Leiterin der Studie. Die Erkenntnisse können in Zukunft dazu beitragen, die Entwicklung von Organismen, aber auch Fehlentwicklungen, besser zu verstehen. Die Studie ist in der Fachzeitschrift „Nature Cell Biology“ erschienen.
Die Geschichte im Detail:
Die Forscher sahen sich Fruchtfliegen im Wachstum an und untersuchten, wie sich das Deckgewebe, das sogenannte Epithel, ihrer Flügel entwickelt. Mithilfe eines Laserstrahls isolierten die Wissenschaftler einzelne Epithelzellen von ihrer Umgebung und untersuchten ihre mechanischen Eigenschaften getrennt voneinander. So fanden sie heraus, dass in diesem frühen Entwicklungsstadium jede einzelne Zelle mechanisch eigenständig ist und nicht durch äußere Kräfte beeinflusst wird: Die Forscher beobachteten, dass die Zellen auch ohne den Kontakt zur Nachbarschaft ihre Form behielten. Dabei schienen es die Mikrotubuli zu sein, die die Zellen stabilisierten. Sie befanden sich jeweils an der oberen Achse der Zelle, also der Seite, die in Richtung der äußeren Umgebung zeigte. „Wir schlossen daraus, dass die Mikrotubuli durch diese polarisierte Ausrichtung Druckkräfte erzeugen und der Spannung entgegenwirken, die wiederum entsteht, wenn sich Aktin- und Myosinfasern zusammenziehen“, sagt Amrita Singh, Doktorandin der Graduiertenschule des Exzellenzclusters und Erstautorin der Studie.
In einem nächsten Schritt markierten die Forscher die Mikrotubuli und beobachteten sie mithilfe hochauflösender Mikroskopie im lebenden Organismus. Es zeigte sich, dass die Mikrotubuli nicht statisch, sondern dynamisch sind: Sie wachsen, bis sie die Zellplasmaschicht an der Innenseite der Zellmembran erreichen, wo sie sich zusammenkrümmen. Mithilfe eines Laserstrahls isolierten die Forscher einzelne Mikrotubuli und beobachteten, dass sehr schnell ihre gebogene Form verloren und sich glätteten – was bedeutete, dass die Mikrotubuli innerhalb der Zelle tatsächlich Druckkräfte erzeugen können. Blockierten die Forscher diese Kräfte mit hemmenden Wirkstoffen, führte das im Umkehrschluss zu Verkürzungen der Zelle. „Die Kräfte der Mikrotubuli sind somit die Haupttreiber der ersten Zellveränderungen während der frühen Phase der Gewebeentwicklung“, sagt Maja Matis.
Indem sie genetisch veränderte Fruchtfliegen untersuchten, fanden die Wissenschaftler außerdem mehr über die molekularen Mechanismen heraus, die dazu führen, dass sich die Kräfte über das gesamte Gewebe ausbreiten. Der sogenannte Planare Zellpolaritäts-Signalweg (Ft-PCP) löst dabei eine Reihe aufeinanderfolgender Signale aus: Moleküle bewirken, dass sich die Mikrotubuli in einem spezifischen Muster anordnen und an die Kontaktstellen zweier benachbarter Zellen heften. In allen Zellen bildet sich das gleiche Muster aus Mikrotubuli. Die so entstehenden Druckkräfte werden an benachbarte Zellen übermittelt, wodurch diese gemeinsam das Gewebe formen.
Da der Ft-PCP-Signalweg bei vielen Entwicklungsprozessen eine zentrale Rolle spielt, liefern die Ergebnisse neue Ansätze, um solche Erkrankungen in Zukunft besser zu verstehen – zum Beispiel Defekte im Neuralrohrverschluss sowie bestimmte Nierenerkrankungen, Formen der Taubheit oder Skelettanomalien.
Förderung:
Die Studie erhielt finanzielle Unterstützung durch den Exzellenzcluster „Cells in Motion“ der Universität Münster, das Interdisziplinäre Zentrum für klinische Forschung der Universität Münster und das von der Deutschen Forschungsgemeinschaft geförderte Schwerpunktprogramm „Epithelial intercellular junctions as dynamic hubs to integrate forces, signals and cell behaviour“.
Originalpublikation:
Singh A, Saha T, Begemann I, Ricker A, Nüsse H, Thorn-Seshold O, Klingauf J, Galic M, Matis M. Polarized microtubule dynamics directs cell mechanics and coordinates forces during epithelial morphogenesis. Nat Cell Biol. 2018; 20: 1126–1133. Abstract

