Entzündungsprozessen auf der Spur
Welche molekularen Mechanismen stecken dahinter, wenn Immunzellen bei Entzündungen aus dem Blutgefäß ins Gewebe wandern? Forscherinnen und Forscher des Exzellenzclusters „Cells in Motion“ der Universität Münster haben neue Erkenntnisse darüber gewonnen: Das Protein Laminin 511 beeinflusst, wie durchlässig die innere Zellschicht der Blutgefäßwand für Immunzellen ist. Die Studie ist aktuell in der Fachzeitschrift „Cell Reports“ erschienen.
Immunzellen, die Leukozyten, sind eine Art Gesundheitspolizei des Körpers. Sie zirkulieren im Blutstrom und patrouillieren durch die Gefäße aller Organe. Bei Entzündungen wandern Immunzellen aus dem Blut ins Gewebe und bekämpfen dort die Entzündung. Um ins Gewebe zu gelangen, müssen sie zwei Barrieren überwinden – zum einen eine enge Schicht aus Endothelzellen, die die Blutgefäße auskleiden. Sie sitzen an der Innenseite einer zweiten Barriere: der Basalmembran. Sie bildet die äußere Wand der Gefäße. Nachdem die Immunzellen das Endothel überwunden haben, bleiben sie zunächst zwischen den Endothelzellen und der Basalmembran sitzen und durchwandern dann die Basalmembran.
In vorherigen Studien hatten Wissenschaftler des Exzellenzclusters „Cells in Motion“ herausgefunden, dass Proteine der Basalmembran, die sogenannten Laminine, die Wanderung der Immunzellen beeinflussen – sie bestimmen zum Beispiel, an welchen Stellen Immunzellen die Basalmembran durchqueren. Nun fanden die Wissenschaftler heraus, dass diese Bestandteile der Basalmembran auch für die Beschaffenheit der innen liegenden Endothelzellschicht verantwortlich sind. „Ein bestimmtes Laminin, das Laminin 511, beeinflusst, wie eng die Endothelzellen aneinander liegen“, erklärt Biochemikerin Prof. Dr. Lydia Sorokin. Das geschieht, indem das Laminin auf andere Moleküle wirkt: Zum einen stärkt es das Molekül VE-Cadherin, das an den Kontaktstellen aneinandergrenzender Endothelzellen vorkommt und quasi einen Klettverschluss zwischen ihnen bildet. Zum anderen verringert Laminin 511 die Menge eines Moleküls, das die Bezeichnung „CD99L2“ trägt. Es befindet sich sowohl auf den Endothel- als auch auf den Immunzellen und bewirkt, dass die beiden Zelltypen aneinander binden. Verringert sich die Menge des Moleküls auf dem Endothel und dadurch die Bindungsfähigkeit an Immunzellen, hemmt dies das Ausströmen der Immunzellen durch die Endothelzellschicht.
Ein weiteres Ergebnis der Studie: Die Forscher zeigten zum ersten Mal, wie lange Immunzellen brauchen, um nach Überquerung der Endothelzellschicht durch die Basalmembran hindurchzuwandern: Sie maßen eine Zeit von 40 Minuten – für die Durchwanderung der Endothelzellschicht benötigten die Immunzellen im Vergleich nur wenige Minuten.
Zuvor hatten die Forscher vorrangig die Blutgefäße im Gehirn von Mäusen untersucht. In der aktuellen Studie sahen sie sich Blutgefäße im Kremastermuskel von Mäusen an, einem vom Unterbauch abzweigenden Muskel. Sie fanden heraus, dass sich das Zusammenspiel der Proteine Laminin und VE-Cadherin in diesen Geweben unterscheidet. „Das zeigt, dass nicht jeder Entzündungsprozess gleich ist, sondern vom jeweiligen Organ abhängt, in dem er auftritt“, sagt Lydia Sorokin.
An der Studie arbeiteten verschiedene Forschergruppen des Exzellenzclusters interdisziplinär zusammen. Bei der Untersuchung handelt es sich um Grundlagenforschung – mögliche Anwendungen sind derzeit nicht absehbar. Grundlegendes Wissen über die Funktion von Blutgefäßen und über Entzündungsprozesse ist allerdings Voraussetzung, um gewebespezifische Entzündungstherapien zu entwickeln.
Die Studie wurde vom Exzellenzcluster „Cells in Motion“ und vom DFG-geförderten Sonderforschungsbereich 1009 „Breaking Barriers“ der Universität Münster unterstützt.
Zur Zusammenarbeit von Forschern verschiedener Disziplinen und zur Methode:
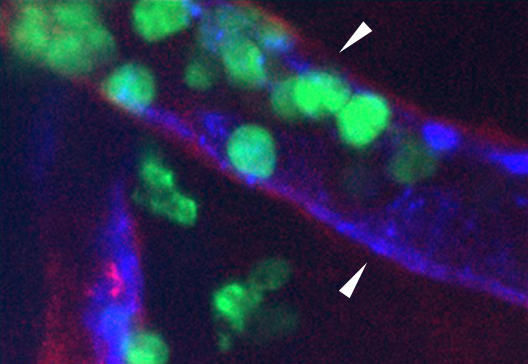
Die Arbeitsgruppe um Biochemikerin Prof. Dr. Lydia Sorokin ist auf die Untersuchung der Laminine spezialisiert, die Gruppe von Biochemiker Prof. Dr. Dietmar Vestweber beschäftigt sich schon lange mit dem Molekül VE-Cadherin. Anästhesist Prof. Dr. Alexander Zarbock brachte eine spezielle Methode ein, die Intravital-Mikroskopie. „Damit konnten wir die Blutgefäße und wandernden Immunzellen im sehr dünnen Muskel sichtbar machen und die schwer zu visualisierende Basalmembran anschauen. Wir haben dazu spezielle Antikörper aus unserem Labor genutzt, mit denen wir Laminin 511 aufspüren können“, erklärt Lydia Sorokin. In Mäusen, deren Immunzellen mit dem „Grün fluoreszierenden Protein“ (GFP) genetisch markiert waren, beobachteten die Forscher, an welchen Stellen die Immunzellen die Barrieren vermehrt durchwanderten. Die Basalmembran wurde mit einem rot fluoreszierenden Antikörper markiert, die Endothelzellschicht mit einem blau fluoreszierenden Signal. Wenn der fluoreszierende Stoff zu lange belichtet wird, bleicht er allerdings aus. Die Aufgabe von Mathematiker Prof. Dr. Benedikt Wirth war es daher, zu rekonstruieren, wo sich die rot und grün fluoreszierenden Signale ursprünglich angesiedelt hatten. Darüber hinaus brachte Neurologe Prof. Dr. Heinz Wiendl eine Methode ein, um den Widerstand der Endothelzellschicht zu messen, bevor und während die Immunzellen durch diese Barriere wandern.
Originalpublikation:
Song J, Zhang X, Büscher K, Wang Y, Wang H, Di Russo J, Li L, Ludke-Enking S, Zarbock A, Stadtmann A, Striewski P, Wirth B, Kuzmanov I, Wiendl H, Schulte D, Vestweber D, Sorokin L. Endothelial basement membrane laminin 511 contributes to endothelial junctional tightness and thereby inhibits leukocyte transmigration. Cell Rep 2017, DOI: 10.1016/j.celrep.2016.12.092 Abstract

