Elektrolytzersetzung verstehen: MEET Wissenschaftler bringen Licht ins Dunkel
Erst die Lithium-Ionen-Batterie (LIB) ermöglicht es, dass wir Smartphones, Tablets, Digitalkameras und portable Konsolen wie selbstverständlich in unserem Alltag nutzen. Doch das Potenzial der LIB ist noch lange nicht ausgeschöpft. Um ihre Leistungsfähigkeit zu steigern, ist es zunächst notwendig, sämtliche Prozesse und Reaktionen in der Batterie bis ins kleinste Detail zu verstehen. Aus diesem Grund haben die MEET Wissenschaftler um Jonas Henschel den Elektrolyten und seine Zersetzungsprodukte genauer unter die Lupe genommen. Denn wie Letztere genau entstehen und welche Auswirkung sie auf das Batteriesystem haben, darüber ist wenig bekannt.
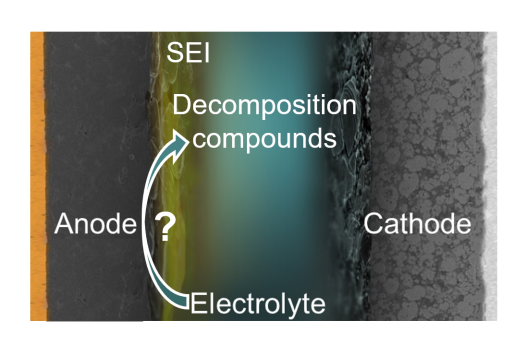
Für den Stromfluss in der Batterie ist der Elektrolyt lebensnotwendig. Während des ersten Ladevorgangs zersetzt er sich. Diese sogenannte Zellformierung ist wichtig, denn dadurch bildet sich die „solid electrolyte interphase“ (SEI), eine Grenzschicht zwischen der Oberfläche der negativen Elektrode und dem Elektrolyten. Indem sie den direkten Kontakt zwischen beiden Materialien verhindert, blockiert sie eine weitere Zersetzung des Elektrolyten. Gleichzeitig ist sie durchlässig für Lithium-Ionen und ermöglicht so den Ladungsaustausch. Die SEI ist dadurch der Schlüssel für wiederaufladbare Batterien mit hoher Kapazität und langer Lebensdauer. „Umso wichtiger ist es, zu verstehen, wie sich Interphasen ausbilden und zusammensetzen“, betont MEET-Doktorand Jonas Henschel.
Warum es unerlässlich ist, die Zersetzungswege verstehen
Ganz vermeiden kann es die SEI aber nicht, dass der Elektrolyt weiterhin reagiert. Sowohl elektrochemische Prozesse als auch thermische Belastung – ausgelöst durch hohe Temperaturen – können zusätzliche Veränderungen hervorrufen. „Es gibt somit neben der vorteilhaften Bildung einer SEI auch unerwünschte Zersetzungsprozesse. Wenn wir wissen, aus welchen Bestandteilen des Elektrolyten sich diese Produkte bilden, können wir sie gezielt modifizieren und so die Zelle optimieren“, erklärt Henschel. Indem solch parasitäre Reaktionen reduziert werden, kann wiederum die Lebensdauer, die Stabilität und die Kapazität der Lithium-Ionen-Batterie verbessert werden, ohne das bestehende System groß zu verändern. Zudem helfen die Erkenntnisse, die Wirkungsweise von vielversprechenden Elektrolytadditiven nachzuvollziehen.
Um die Zersetzungswege der einzelnen Produkte zu verstehen, haben die Wissenschaftler in der Studie einen Elektrolytbestandteil isotopenmarkiert. Mithilfe der Massenspektrometrie und Fragmentierungsexperimenten stellten sie anschließend fest, an welcher Position im Molekül sich die markierten Zersetzungsprodukte befinden und zogen auf dieser Basis Rückschlüsse über deren Bildung.
Detaillierte Ergebnisse in der Studie aufgelistet
Die genauen Ergebnisse, wie die Elektrolytzersetzung unter thermischer und elektrochemischer Belastung abläuft, haben die Autoren Jonas Henschel, Christoph Peschel, Sven Klein, Fabian Horsthemke, Prof. Dr. Martin Winter und Dr. Sascha Nowak in der Fachzeitschrift „Angewandte Chemie“ veröffentlicht. Hier finden Sie die gesamte Studie.

