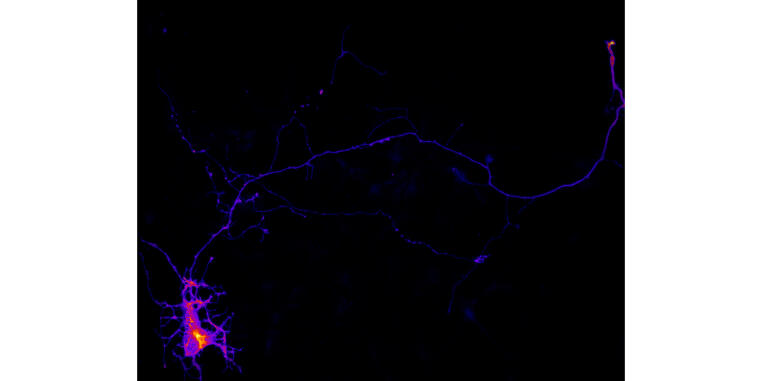
Neue Studie untersucht die Rolle von Phospholipiden und Membranspannung bei der Bildung von Axonen
Mehr zur Arbeit finden Sie hier.
Forschungsförderung
Die Arbeit wurde durch die Deutsche Forschungsgemeinschaft (DFG) unterstützt.
Originalpublikation
Di Meo, D., Kundu, T. Ravindran, P., Shah, B, Püschel, A.W. (2024). Pip5k1γ regulates axon formation by limiting Rap1 activity. Life Sci Alliance 7: e202302383. doi: 10.26508/lsa.202302383.
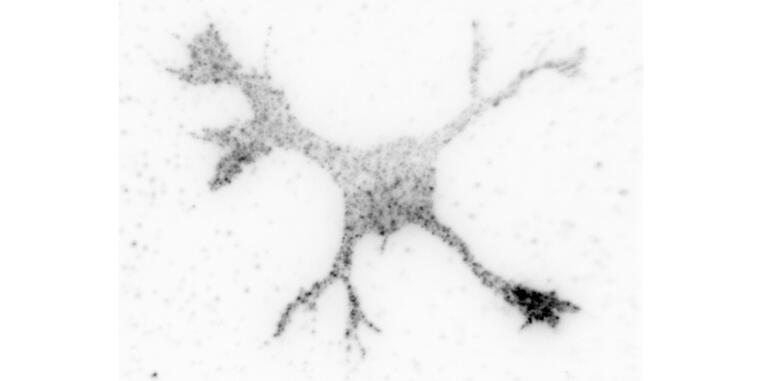
Neue Function der GTPase Cdc42 während der Axonbildung entdeckt
Mehr zur Arbeit finden Sie hier.
Forschungsförderung
Die Arbeit wurde durch die Deutsche Forschungsgemeinschaft (DFG) unterstützt.
Originalpublikation
Ravindran P, Püschel AW (2022). An isoform-specific function of Cdc42 in regulating mammalian Exo70 during axon formation. Life Sci Alliance: e202201722. doi: 10.26508/lsa.202201722.
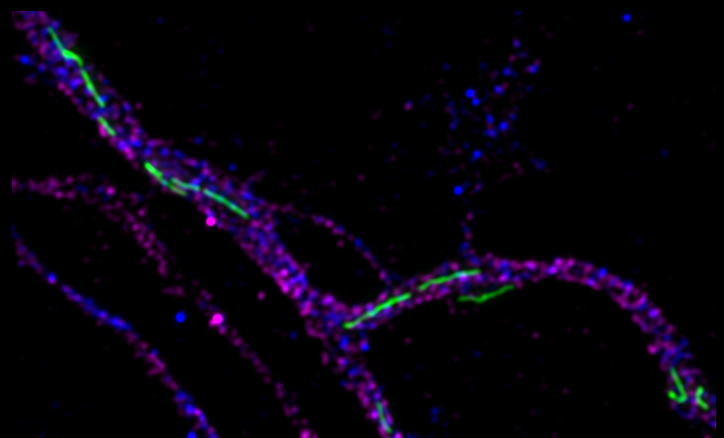
Neuer Signalweg zur Regulierung axonaler Mitochondrien entdeckt
Mehr zur Arbeit finden Sie hier.
Forschungsförderung
Die Arbeit wurde durch die Deutsche Forschungsgemeinschaft (DFG) unterstützt.
Originalpublikation
Di Meo, D., Ravindran, P., Sadhanasatish, T., Dhumale, P., Püschel, A.W. (2021). The balance of mitochondrial fission and fusion in cortical axons depends on the kinases SadA and SadB. Cell Rep. 37, 110141. doi: 10.1016/j.celrep.2021.110141.
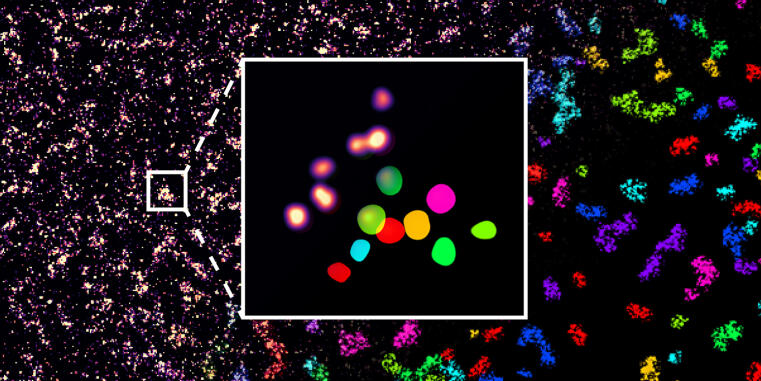
Optimiertes Mikroskopie-Verfahren ermöglicht Einzelmolekül-Detektion unter nativen Bedingungen
WWU Forscher optimieren Hochauflösungsmikroskopie-Anwendung zur Einzelmolekül-Detektion / Studie als Coverstory in ChemBioChem publiziert
Die Entwicklung der Hochauflösungsmikroskopie, die 2014 mit dem Nobelpreis ausgezeichnet wurde, erlaubt die Analyse zellbiologischer Prozesse mit einer Präzision von wenigen Nanometern, was sogar die Unterscheidung einzelner Moleküle innerhalb von Zellen möglich macht. Eine Limitation dieser Methode ist jedoch, dass in aller Regel die Zielmoleküle genetisch modifiziert werden müssen, um eine möglichst präzise Messung zu erreichen. Forschern an der WWU Münster haben nun ein Proteinmarkierungs-Verfahren optimiert, so dass auch native, nicht-modifizierte Proteine in ihrer natürlichen Umgebung auf der Einzelmolekülebene sichtbar gemacht und quantifiziert werden können.
Hintergrund und Methode
Hochauflösungsmikroskopie wird in der Regel mit einem Verfahren ermöglicht, bei dem durch eine kurzzeitige Anbindung von fluoreszent-markierten Proben Signale an einzelnen Molekülen erzeugt werden, wodurch deren genaue Lokalisation innerhalb der Zelle berechnet werden kann. Hierzu wird jedoch in aller Regel das zu untersuchende Molekül genetisch modifiziert. DNA-PAINT beruht zum Beispiel darauf, dass eine DNA-Bindestelle an das Zielprotein angebracht wird, an die wiederum komplementäre, fluoreszierende DNA-Stränge zur Detektion binden können. Andere Hochauflösungsmikroskopie-Methoden beruhen auf der Modifikation durch fluoreszente Proteine, die nach Wunsch an- und ausgeschaltet werden. Da solche genetischen Modifikationen in vielen Anwendungen aber unerwünscht und mitunter auch gar nicht möglich sind, bedarf es neuer Methoden zur Detektion nicht modifizierter, endogener Proteine.
Lisa Fischer, Doktorandin in der Arbeitsgruppe von Prof. Carsten Grashoff, entwickelte daher nun ein Verfahren, genannt Direct Peptide-PAINT, mit dem ein zentrales Zelladhäsionsprotein, Talin, mit einem fluoreszierenden Interaktions-Peptid markiert werden kann. Die erste Anwendung lieferte so nicht nur ersten Einblicke in die Verteilung dieses Moleküls in differenzierenden Stammzellen, es konnten auch erstmals einzelne Talin-Proteine in Gewebeschnitten sichtbar gemacht werden. Das neue Verfahren scheint daher geeignet, um die Untersuchung von Adhäsionsprozessen unter patho-physiologischen relevanten Bedingungen möglich zu machen. Die Forscher erwarten, dass dies wichtige, molekulare Einblicke in Krankheitsbilder erlaubt, denen eine dysfunktionale Zelladhäsion zu Grunde liegt.
Forschungsförderung
Die Arbeiten wurden durch die Deutsche Forschungsgemeinschaft (DFG) und dem Human Frontier Science Programm gefördert.
Originalpublikation
Lisa S. Fischer, Thomas Schlichthaerle, Anna Chrostek-Grashoff, and Carsten Grashoff. Peptide-PAINT Enables Investigation of Endogenous Talin with Molecular Scale Resolution in Cells and Tissues. DOI: 10.1002/cbic.202100301

Zentraler Adhäsionskomplex durch neues Analyseverfahren nachgewiesen
Forscher der WWU entwickeln neues Verfahren zur Einzelmolekülanalyse / Studie in „Nature Communications“
Die Zellen von Organismen sind aus Untereinheiten aufgebaut, die sich aus einer Vielzahl einzelner Moleküle zusammensetzen. Wie sich diese unterschiedlichen Proteine auf molekularer Ebene anordnen, ist in vielen Fällen allerdings noch unverstanden, da es an geeigneten Analyseverfahren mangelt. Forscherinnen und Forscher an der Westfälischen Wilhelms-Universität (WWU) Münster haben nun in Zusammenarbeit mit Kollegen am Max-Planck-Institut für Biochemie, München, ein Verfahren entwickelt, mit dem sich die Anordnung und Dichte von einzelnen Proteinen in Zellen bestimmen lässt. Durch die Anwendung der neuen Analysemethode wies das Team einen Komplex aus drei sogenannten Adhäsionsproteinen nach, der für die Fähigkeit von Zellen, sich im Gewebe anheften zu können, eine zentrale Rolle zu spielen scheint. Die Studienergebnisse wurden jetzt in der Fachzeitschrift „Nature Communications“ veröffentlicht.mehr
Finanzierung
Die Arbeiten wurden durch die Deutsche Forschungsgemeinschaft (DFG) gefördert.
Originalpublikation
L.S. Fischer, C. Klingner, T. Schlichthaerle, M.T. Strauss, R. Böttcher, R. Fässler, R. Jungmann, C. Grashoff. Quantitative single-protein imaging reveals molecular complex formation of integrin, talin, and kindlin during cell adhesion. Nature Communications 12, 919 (2021). DOI: 10.1038/s41467-021-21142-2
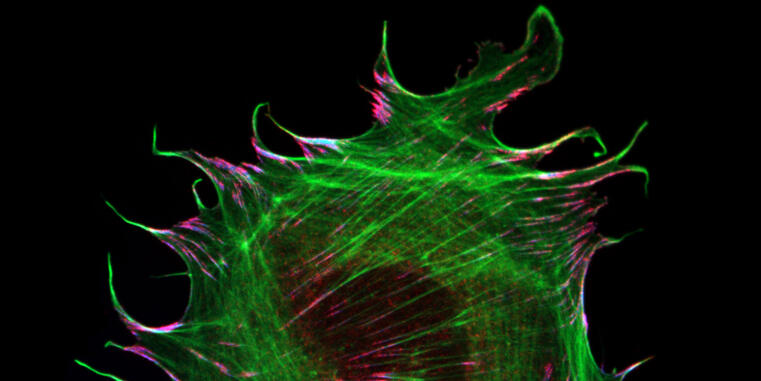
Neuer Mechanismus der molekularen Kraftübertragung in Muskelzellen entdeckt
Forscher der WWU weisen mechano-biologische Funktion eines Muskel-spezifischen Proteins nach / Studie in Nature Communications publiziert
Die Fähigkeit von Zellen, mechanische Reize erkennen und beantworten zu können, ist für eine Vielzahl zellulärer Prozesse wichtig. Die Mechanismen, welche diesen Prozessen zu Grunde liegen, sind jedoch auf molekularer Ebene noch weitgehend unverstanden. Wissenschaftler der Universität Münster haben nun herausgefunden, wie das muskelspezifische Adhäsionsprotein Metavinkulin die Übertragung mechanischer Kräfte in Zellen moduliert. Ihre Arbeit wurde vor kurzem in Nature Communications veröffentlicht.
Hintergrund und Methode
Die Interaktion von Zellen mit dem umgebenden Gewebe werden von spezialisierten Adhäsionsstrukturen vermittelt, die mechanischer Informationen in und aus der Zelle weiterleiten. Da diese Strukturen aus einer Vielzahl unterschiedlicher Proteine bestehen, ist es aber unklar, wie mechanische Signale auf molekularer Ebene übertragen werden. Um derartige Prozesse genauer verstehen zu können, entwickelt das Grashoff Labor an der WWU Münster Biosensoren, mit denen durch mikroskopische Verfahren mechanische Kräfte von nur wenigen Pikonewton bestimmt werden können. In der neuesten Studie wurde diese Technik auf Metavinkulin angewandt, ein Adhäsionsprotein das in Muskelzellen vorkommt und mit einer Herzerkrankung, genannt Kardiomyopathie, in Verbindung gebracht wird.
Indem eine Reihe genetisch veränderter Zellen mikroskopisch vermessen wurden, konnten die Autoren nun nachweisen, dass die Gegenwart von Metavinkulin die Art der molekularen Kraftübertragung moduliert. “Unsere Daten zeigen, dass Metavinkulin eine Funktion als mechanisches Dämpfer-Protein haben könnte, damit Muskelgewebe hohen mechanischen Belastungen besser standhalten“, erklärt der Studienleiter Prof. Dr. Carsten Grashoff. “Dies ist ein recht interessantes Beispiel dafür, wie einzelne Proteine die Kraftübertragung in Zellen verändern können.”
Überraschenderweise fanden die Autoren im Mausmodell keinen Hinweis darauf, dass die Abwesenheit von Metavinkulin zu Kardiomyopathie führt. Dies weist darauf hin, dass die Funktion von Metavinkulin deutlich komplexer ist als bisher gedacht.mehr
Forschungsförderung
Die Arbeiten wurden durch die Deutsche Forschungsgemeinschaft (DFG) gefördert.
Originalpublikation
Verena Kanoldt, Carleen Kluger, Christiane Barz, Anna-Lena Schweizer, Deepak Ramanujam, Lukas Windgasse, Stefan Engelhardt, Anna Chrostek-Grashoff, and Carsten Grashoff. Metavinculin modulates force transduction in cell adhesion sites. DOI: 10.1038/s41467-020-20125-z.

Myosine: Eine Superfamilie von Molekularmotoren
Ein neues Buch ist erschienen, das umfassend die Myosinproteine, aktinabhängige Motormoleküle, beschreibt. Darin enthalten ist ein Artikel der AG Bähler der das aktuelle Wissen zu den Klasse IX Myosinen zusammenfasst. Klasse IX Myosine besitzen nicht nur einzigartige Motoreigenschaften, sondern sind gleichzeitig negative Regulatoren eines wichtigen Signalweges, der verschiedene zelluläre Prozesse, wie beispielsweise Zellmorphologie und Zellwanderung, steuert.


Wie halten Verknüpfungen von Muskeln und Sehnen ein Leben lang?
Zellbiologen zeigen in Fruchtfliegen, wie ein Protein mechanische Belastungen an Muskel-Sehnen-Verbindungen steuert.
Viele Muskeln sind mit Sehnen verknüpft, was Tieren das Laufen, Schwimmen oder Fliegen ermöglicht. Die dazu notwendigen Kräfte werden von Aktin- und Myosinfasern erzeugt, die an Muskel-Sehnen-Verknüpfungen angeheftet sind und daran ziehen. Während der Entwicklung müssen diese Muskel-Sehnen-Verknüpfungen so gebaut werden, dass sie die hohen mechanischen Kräfte aushalten, die während des Lebens auftreten können. Ein interdisziplinäres Team aus dem französischen Marseille, München und Münster hat es nun geschafft, die mechanischen Kräfte zu messen, die an einem Muskel-Sehnen-Verknüpfungsprotein namens Talin ziehen. Die Wissenschaftlerinnen und Wissenschaftler nutzten die Flugmuskulatur der Fruchtfliege Drosophila für diese molekularen Kraftmessungen und stellten fest, dass bei der Entwicklung von Muskel-Sehnen-Verknüpfungen nur ein überraschend kleiner Anteil der Talin-Moleküle Kräften ausgesetzt ist. Gleichzeitig fanden sie heraus, dass die Muskeln eine hohe Anzahl von Talin-Molekülen an den Verknüpfungen ansammeln, um mit den zunehmenden Kräften im Gewebe umgehen zu können. Auf diese Weise können sich viele Talin-Moleküle die hohen Kräfte der Muskelkontraktionen, zum Beispiel während des Fliegens, dynamisch aufteilen. „Dieses mechanische Anpassungskonzept ermöglicht, dass Muskel-Sehnen-Verknüpfungen ein Leben lang halten können“, sagt Sandra Lemke, Biologiedoktorandin am Max-Planck-Institut für Biochemie (MPIB) in Martinsried, die den Großteil der Experimente durchführte. Leiter der Studie waren Dr. Frank Schnorrer vom Institut für Entwicklungsbiologie der Universität Marseille und Prof. Dr. Carsten Grashoff von der Westfälischen Wilhelms-Universität Münster (WWU). Die Studie ist in der Fachzeitschrift „Plos Biology“ erschienen. (mehr)
Originalpublikation
S. Lemke et al. (2019): A small proportion of Talin molecules transmit forces at developing muscle attachments in vivo. PLOS Biology; DOI: 10.1371/journal.pbio.3000057

Neue Komponente der Herzmuskulatur entdeckt
WWU-Forscher identifizieren bislang unbekannte Funktionsweise eines Motorproteins.
Damit das Herz richtig arbeiten kann, muss es Muskelkraft aufbringen. Dies geschieht, indem sich zahlreiche Sarkomere, die kleinsten Einheiten des Herzmuskels, verkürzen. Die hierzu notwendige Zugkraft basiert auf der Aktivität von klassischen Motorproteinen, die ihrerseits Proteinfäden des Sarkomers gegeneinander verschieben. Wissenschaftlerinnen und Wissenschaftler der Westfälischen Wilhelms-Universität Münster (WWU) haben nun in Kooperation mit Forschern aus dem kanadischen Toronto und dem niederländischen Leiden mehr über die Funktion eines bestimmten Motorproteins herausgefunden, dem Myosin 18A, kurz Myo18A. Sie entdeckten, dass eine neue Variante des Proteins für die mechanische Stabilisierung des Sarkomers im Herzen verantwortlich ist. Die Ergebnisse könnten dabei helfen, die Grundlagen des Herzmuskel-Aufbaus und dessen Kontraktion besser zu verstehen. Die Studie ist in der Fachzeitschrift „The Journal of Biological Chemistry“ erschienen und als Forschungshöhepunkt, dem „Editors’ Pick“, ausgezeichnet worden. (mehr)
Förderung
Die Studie erhielt finanzielle Unterstützung durch die Deutsche Forschungsgemeinschaft, den Exzellenzcluster „Cells in Motion“ der Universität Münster und die kanadischen Forschungsorganisationen „Genome Canada“ und „Ontario Genomics“.
Originalpublikation
Horsthemke M. et al. (2019): A novel isoform of myosin 18A (Myo18Aγ) is an essential sarcomeric protein in mouse heart. Journal of Biological Chemistry; DOI: 10.1074/jbc.RA118.004560
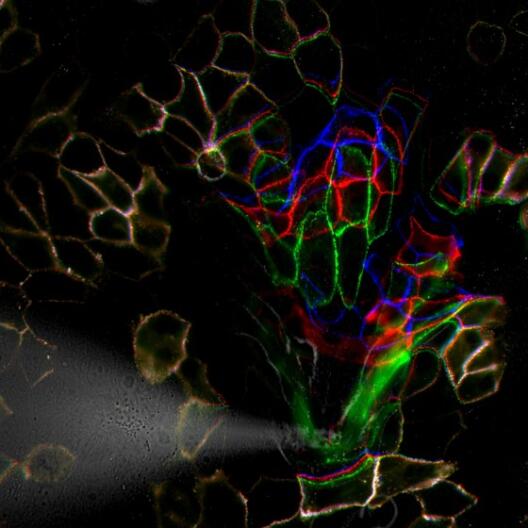
Wie sich Hautzellen vor mechanischem Stress schützen
Zellbiologen der Universität Münster entwickeln neues Verfahren um die Verarbeitung mechanischer Kräfte in Zellen zu messen.
Die Haut ist unser größtes Organ und dient unter anderem dem Schutz vor mechanischen Einflüssen. Um diesen Schutz zu gewährleisten, müssen Hautzellen besonders eng miteinander verbunden sein. Wie genau diese mechanische Stabilität vermittelt wird, war jedoch lange Zeit unklar. Forscherinnen und Forscher in der Arbeitsgruppe von Prof. Dr. Carsten Grashoff des Instituts für Molekulare Zellbiologie der Westfälischen Wilhelms-Universität Münster (WWU) und des Max-Planck-Instituts für Biochemie konnten nun gemeinsam mit Kollegen der Stanford Universität (USA) zeigen, wie mechanische Belastungen an speziellen Zell-Haltepunkten, den sogenannten Desmosomen, verarbeitet werden. Dazu haben sie ein Minimessgerät entwickelt, mit dem Kräfte entlang einzelner Bestandteile in Desmosomen bestimmt werden können. In der in Nature Communications veröffentlichten Studie zeigen sie mit Hilfe der Technik, wie mechanische Kräfte an diesen speziellen Haltepunkten verarbeitet werden. (mehr)
Originalpublikation
Price, J. A.; Cost, A. L.; Ungewiß, H.; Waschke, J.; Dunn, A. R.; Grashoff, C. Mechanical loading of desmosomes depends on the magnitude and orientation of external stress. Nature Communications (2018). DOI: 10.1038/s41467-018-07523-0.
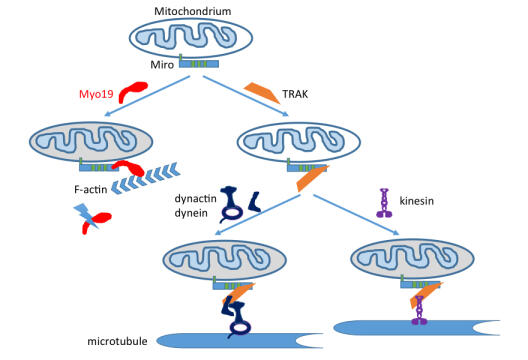
Wie in Zellen Zugmaschinen mit ihrer Fracht verbunden werden und ihren Auslieferungsort erreichen
AG Bähler veröffentlicht neue Forschungsergebnisse.
Mitochondrien sind die Kraftwerke der Zelle. Sie besitzen eigene Erbinformation und können daher nicht neu entstehen und müssen bei der Zellteilung gleichmäßig auf die Tochterzellen verteilt werden. Mitochondrien können in Zellen entlang zwei verschiedener Verkehrswege, den Zytoskelettfasern Mikrotubuli und Aktinfilamente, transportiert werden. Arbeiten der AG Bähler haben nun die Anheftungsstelle an Mitochondrien für das Motormolekül Myosin XIX (Myo19), das den Transport der Mitochondrien entlang von Aktinfilamenten vermittelt, identifiziert. Diese Anheftungsstelle stabilisiert das Motormolekül Myo19. Wenn die Anheftungsstelle fehlt, wird das Motormolekül Myo19 entsorgt. Interessanterweise dient diese Anheftungsstelle auch indirekt über ein Verbindungsstück für die Anheftung der für den bidirektionellen Transport der Mitochondrien entlang der Mikrotubuli verantwortlichen Motoren. Es gibt daher ein Gerangel der drei Motoren um die gleiche Anheftungsstelle an den Mitochondrien und dementsprechend ihre korrekte Verteilung und Auslieferung.
Originalpublikation
Oeding SJ, Majstrowicz K, Hu XP, Schwarz V, Freitag A, Honnert U, Nikolaus P, Bähler M.
J Cell Sci. 2018 Sep 10;131(17). pii: jcs219469. doi: 10.1242/jcs.219469.

Carsten Grashoff mit BINDER Innovationspreis 2018 ausgezeichnet
Die Deutsche Gesellschaft für Zellbiologie (DGZ) zeichnet alljährlich herausragende Forschung im Bereich der Zellbiologie mit dem BINDER Innovationspreis aus. Die Ehrung wird in diesem Jahr an Prof. Dr. Carsten Grashoff für die Entwicklung von Methoden vergeben, welche eine quantitative Analyse mechanischer Kräfte in Zellen ermöglichen. Die Technik erlaubt die Untersuchung molekularer, mechanischer Prozesse unter physiologischen Bedingungen und ist daher zu einem bedeutenden Werkzeug geworden, um mechano-biologische Vorgänge in Zellen und Geweben zu vermessen. Der Preisverleihung findet im Rahmen des diesjährigen internationalen Kongresses der DGZ in Leipzig am 17. September 2018 statt.
Die Fähigkeit, mechanische Kräfte generieren, erkennen und auf sie antworten zu können, ist eine der fundamentalen Eigenschaften von Zellen. Wie mechanische Signale jedoch auf molekularer Ebene verarbeitet werden, war lange Zeit unklar. Ein Grund dafür war das Fehlen geeigneter Verfahren, mit denen mechanische Kräfte bestimmt werden können, die auf einzelnen Molekülen in Zellen lasten. Carsten Grashoff und seine Arbeitsgruppe haben solche Methoden entwickelt und optimiert, so dass kleinste mechanische Kräfte von nur wenigen Piconewton in Zellen quantifiziert werden können. Durch Einbringen von genetisch verschlüsselten, kalibrierten Kraftsensoren in spezifische Proteine und durch Expression dieser Konstrukte in Zellen, können Änderungen molekulare Zugkräfte durch quantitative Mikroskopie-Verfahren zeitlich und räumlich aufgelöst werden. Erste Studien des Grashoff Labors fokussierten auf Prozesse der Zelladhäsionsmechanik und führten zu der Entdeckung einer mechanischen Bindung, die für die Rigiditätserkennung von Zellen eine entscheidende Rolle spielt. Diese sogenannte Kraftsensor-Technik wurde mittlerweile von vielen anderen Arbeitsgruppen angewendet, um eine Vielzahl biomechanischer Prozesse genauer zu untersuchen.
Carsten Grashoff studierte Angewandte Naturwissenschaft an der Universität Freiberg und promovierte 2007 am Max-Planck-Institut für Biochemie. Im Anschluss arbeitete er an der Universität von Virginia (USA) and kehrte 2011 als unabhängiger Gruppenleiter an das Max-Planck-Institut für Biochemie zurück. 2018 wurde Carsten Grashoff von der Universität Münster zum Professor ernannt.
Die Deutsche Gesellschaft für Zellbiologie (DGZ) vertritt die Interessen der Zellbiologie als selbstständige, multidisziplinäre und fachintegrierende Wissenschaft in Deutschland. Der BINDER Innovationspreis wird seit 1998 für herausragende Studien auf dem Gebiet der Zellbiologie vergeben. Das Preisgeld von 4000 Euro wird von der BINDER GmbH gestiftet.

Mit Spinnengewebe-Proteinen kleinste Kräfte in Zellen messen
Mit molekularer Kraftübertragung in Zellen beschäftigt sich Prof. Dr. Carsten Grashoff vom Institut für Molekulare Zellbiologie der WWU, in seiner Antrittsvorlesung am Freitag, 22. Juni.
Der Vortrag beginnt um 16.15 Uhr im Hörsaal ZH, Badestraße 9. Alle Interessierten sind zu der Veranstaltung eingeladen. Der Eintritt ist frei. (mehr)

"Human Frontier Science Program" fördert zwei Projekte mit WWU-Beteiligung
Der renommierte Forschungsförderpreis "Program Grant" des internationalen "Human Frontier Science Program" geht in der Auswahlrunde 2018 an zwei Angehörige des Fachbereichs Biologie der WWU: an den Bioinformatiker Prof. Dr. Erich Bornberg-Bauer und die Zellbiologin Prof. Dr. Karin Busch. (mehr)

Ernennung
Dr. Carsten Grashoff vom Max-Planck-Institut für Biochemie, Martinsried, wurde zum 15. Januar 2018 zum Universitätsprofessor für das Fach "Quantitative Zellbiologie" am Institut für Molekulare Zellbiologie berufen.


