Zelldynamik und Bildgebung
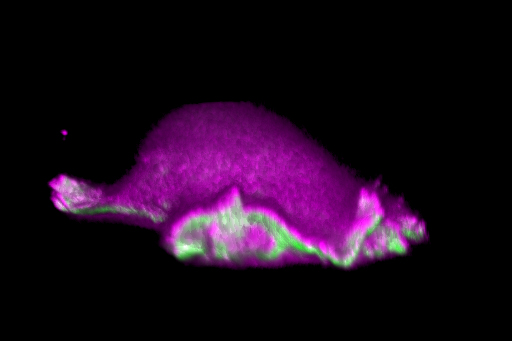
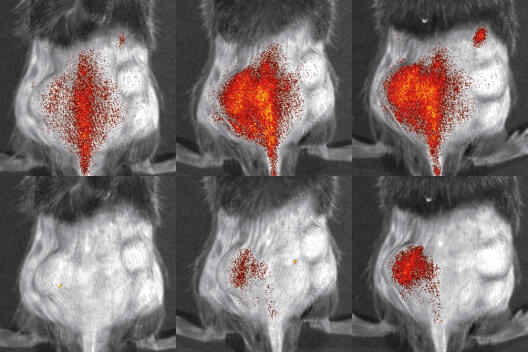
Die Mitglieder unseres Wissenschaftsverbundes untersuchen, wie sich Zellen in Organismen bewegen und verhalten. Um Vorgänge im Organismus sichtbar zu machen und analysieren zu können, nutzen und entwickeln sie innovative Bildgebungsmethoden. Mediziner, Biologen, Chemiker, Pharmazeuten, Mathematiker, Informatiker und Physiker arbeiten dabei eng zusammen.
Unser Verbund ist die tragende Säule des Bereichs „Zelldynamik, Entzündung und Bildgebung“ im Forschungsprofil der Universität Münster. Wir fördern die Vernetzung und Zusammenarbeit von Forschenden verschiedener Fakultäten in diesem Gebiet und sind dadurch Inkubator für neue interdisziplinäre Fragestellungen, die dazu beitragen, den Forschungsschwerpunkt weiterzuentwickeln.