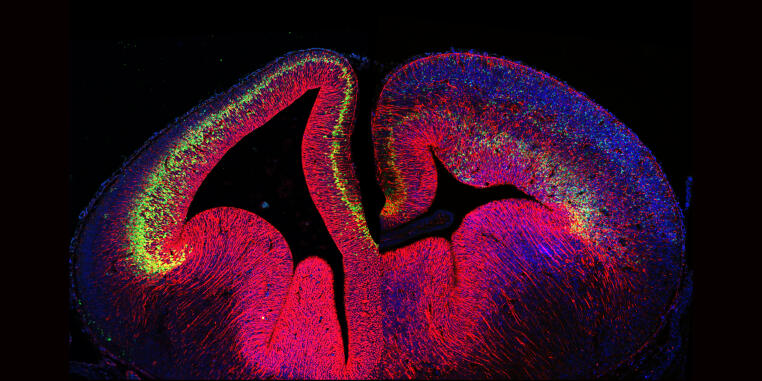











Das Institut für Integrative Zellbiologie und Physiologie (IIZP) ist in 2021 aus dem Zusammenschluss des ehemaligen Instituts für Molekulare Zellbiologie (IMZ) und des Instituts für Zoophysiologie (IZP) hervorgegangen.
Dieses Institut entstand aus der Erkenntnis, dass physiologische und zellbiologische Prozesse eng miteinander verknüpft sind und nicht unabhängig voneinander verstanden werden können. Das IIZP hat die Mission, die komplexen Strukturen und physiologischen Prozesse in tierischen Zellen und Organismen auf unterschiedlichen Zeit- und Größenskalen zu untersuchen. Unser Ziel ist es, durch diesen Ansatz die molekularen, zellulären und biophysikalischen Prinzipien entwicklungsbiologisch, physiologisch und pathologisch relevanter Prozesse aufzuklären.
Die Forschungsarbeiten am IIZP integrieren Experimente an einzelnen Molekülen, isolierten Zellen, Geweben und lebenden Organismen. Dabei werden unterschiedliche Modellsysteme genutzt, die von Zellkulturen, Amöben, Krebstieren, Fadenwürmern und Fruchtfliegen bis hin zum Mausmodell reichen. Für unseren integrativen Forschungsansatz kombinieren wir biochemische und genetische Verfahren mit hoch-auflösenden, quantitativen Mikroskopie-Methoden.
Weitere Informationen finden Sie auf den Seiten unserer Forschungsgruppen.
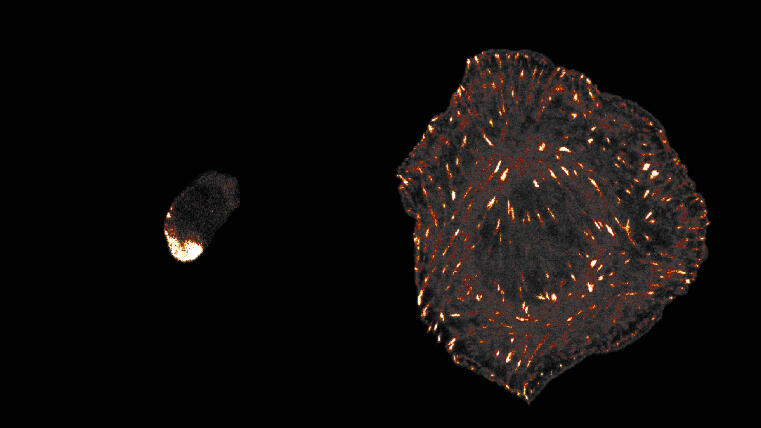
Forscher Biologen der Universität Münster entdecken evolutionären Ursprung der Fähigkeit von Tierzellen, sich festhalten zu können / „Talin“-Protein spielt zentrale Rolle
Die Zellen aller Tiere – und die des Menschen – können sich besonders gut an Oberflächen in ihrer Umgebung festhalten. Diese mechanisch stabile Anheftung erlaubt die Entwicklung komplexer Gewebe und Organe und wird durch bestimmte Zelloberflächenrezeptoren, die sogenannten Integrine, ermöglicht. Wie sich diese Form der Zelladhäsion im Laufe der Evolution entwickelt hat, ist allerdings unklar, denn viele einzellige Organismen weisen keine Integrin-Rezeptoren auf. Ein Team um Prof. Dr. Carsten Grashoff und die Doktorandin Srishti Rangarajan vom Institut für Integrative Zellbiologie und Physiologie der Universität Münster zeigte nun, dass das sogenannte Talin-Protein eine zentrale und evolutionär konservierte Rolle bei der Zellanheftung spielt.
Hintergrund und Methode
Talin kommt in zahlreichen eukaryotischen (einen Zellkern enthaltenden) Einzellern und auch in allen Tierzellen vor. Das Protein sorgt dort für die mechanische Anbindung von Integrinen an das Zellinnere. Durch vergleichende Untersuchungen in Amöben und Tierzellen wiesen die Forscherinnen und Forscher nun nach, dass Talin – ganz ähnlich wie beim Menschen – auch in Einzellern bei der Zelladhäsion mechanische Kräfte überträgt.
Auch wenn es sich pro Molekül nur um eine Kraft von wenigen Billionstel Newton handelt, so scheint diese mechanische Funktion von Talin für eine erfolgreiche Zellanheftung entscheidend zu sein. Zwar hat das Talin-Protein in menschlichen Zellen eine Vielzahl zusätzlicher Aufgaben, die noch nicht in Amöben zu beobachten sind. Doch die entscheidende mechanische Rolle des Proteins hatte sich vermutlich bereits entwickelt, lange bevor die ersten Tiere entstanden.
Srishti Rangarajan unterstreicht: „Die durch Integrin vermittelte Adhäsion von Tierzellen wird in allen modernen Lehrbüchern der Zellbiologie beschrieben. Sie scheint aber lediglich die Spezialisierung eines deutlich älteren Zelladhäsionsmechanismus zu sein, der in Einzellern entsprang und von Talin vermittelt wird.“
Das Team nutzte unter anderem Methoden der molekularen Genetik, hochauflösende Fluoreszenzmikroskopie sowie molekulare Kraftmikroskopie.
Forschungsförderung
Die Volkswagenstiftung unterstützte die Arbeit finanziell.
Originalpublikation
Srishti Rangarajan, Lena Espeter, Hannes C.A. Drexler, Anna Chrostek-Grashoff and Carsten Grashoff. Talin force coupling underlies eukaryotic cell-substrate adhesion. Nat Commun. 2025 Dec 6;16(1):10950. doi: 10.1038/s41467-025-67354-8


Die Deutsche Forschungsgemeinschaft (DFG) hat am 21. November bekanntgegeben, dass der Sonderforschungsbereich (SFB) „Dynamische zelluläre Grenzflächen: Bildung und Funktion” mit 12 Millionen Euro für vier Jahre weiter gefördert wird.
Der von Prof. Stefan Luschnig vom Institut für Integrative Zellbiologie und Physiologie (IIZP) koordinierte Forschungsverbund kann damit seine erfolgreichen Arbeiten zu grundlegenden Fragen der Zell- und Entwicklungsbiologie sowie der Biomedizin fortsetzen. Das Forschungsteam untersucht, wie Zellen an ihrer Oberfläche miteinander in Kontakt treten und dabei Informationen, Stoffe und mechanische Kräfte austauschen. Diese dynamischen Schnittstellen steuern die Signalverarbeitung und Entwicklung und sind somit von zentraler Bedeutung für die geordnete Gewebearchitektur und die Funktion von Organen. Um diese fundamentalen Prozesse zu verstehen, bündeln die Forscherinnen und Forscher ihre Expertise aus verschiedenen Disziplinen, darunter Computermodellierung, organische Chemie, Strukturbiologie, Genetik sowie Zell- und Entwicklungsbiologie. An dem Verbund sind 27 Wissenschaftlerinnen und Wissenschaftler aus den Fachbereichen Biologie, Chemie und Medizin der Universität Münster beteiligt. Sie arbeiten dabei eng zusammen mit dem Max-Planck-Institut für Molekulare Biomedizin und einem Teilprojekt an der Technischen Universität Dortmund.

Das IIZP begrüßt Dr. Maik Bischoff, der seit Oktober 2025 seine unabhängige Nachwuchsforschungsgruppe am Institut aufbaut. Sein Team untersucht, wie Organe ihre Form und Chiralität erhalten, wobei ein besonderes Interesse mesenchymaler Zellschichten, wie z. B. der glatten Muskulatur, bei der Gestaltung der Organarchitektur gilt.
Unter Verwendung von Drosophila melanogaster als genetisch zugänglichem Modell untersucht die Gruppe, wie kollektive Zellmigration, Mechanosensation und kontaktbasierte Interaktionen komplexe morphogenetische Prozesse vorantreiben. Die wissenschaftlichen Arbeiten kombinieren hochauflösende Live-Zell-Bildgebung, quantitative Bildanalyse, Genetik und Molekularbiologie, um aufzudecken, wie sich das dynamische Verhalten einzelner Zellen in emergente Muster auf Gewebeebene umsetzt.
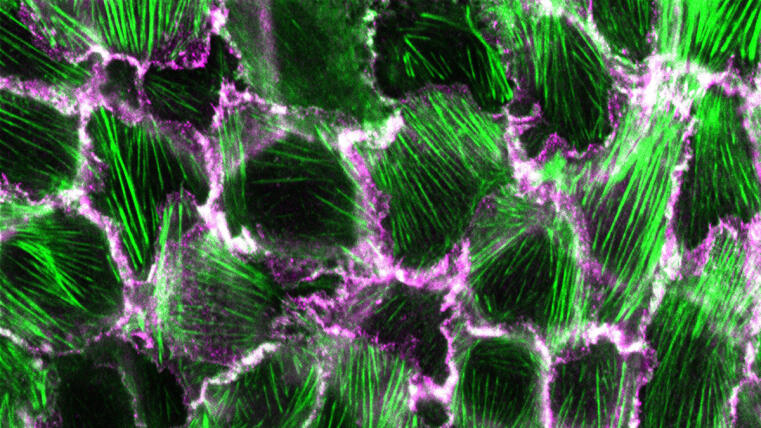
Forscher der Universität Münster entwickeln Methode um Strukturveränderungen eines Adhäsionsproteins sichtbar zu machen / Studie in Communications Biology publiziert
Die Bildung und Erhaltung von Epithelien ist für die Entwicklung und das Überleben aller Tiere von zentraler Bedeutung. Entscheidend für die Integrität dieser Gewebe sind Cadherin-basierte Komplexe, sogenannte Adhäsionsverbindungen, die robuste und dennoch dynamische Zell-Zell-Adhäsionen ausbilden. Die molekularen Details, die der Formierung dieser wichtigen Strukturen zugrunde liegen, sind jedoch noch nicht vollständig geklärt. Eine neue Studie der Grashoff-Gruppe am IIZP gibt Aufschluss über diesen grundlegenden zellbiologischen Prozess.
Hintergrund und Methode
In ihrer kürzlich in Communications Biology veröffentlichten Open-Access-Studie zeigen die Autoren, dass die Reifung von Adhäsionsverbindungen – die beispielsweise in der Haut und im Darm des Menschen zu finden sind – mit einer strukturellen Veränderung innerhalb eines Proteins einhergeht, das sich bereits zuvor als wesentlich für die Bildung von Zell-Zell-Kontakten in Tieren erwiesen hat: α-Catenin. Durch die Kombination eines neuartigen α-Catenin-Biosensors mit Fluoreszenzlebensdauer- und Anisotropie-Bildgebung zeigen die Autoren, dass das Molekül eine kritische Konformationsänderung in seiner C-terminalen Aktin-bindenden Domäne durchläuft, wenn Adhäsionsverbindungen reifen. Überraschenderweise korreliert diese Konformationsänderung, von der man annimmt, dass sie die Zell-Zell-Verbindungen stärkt, mit einem erhöhten Proteinumsatz. Dieser Prozess könnte erklären, warum Epithelgewebe mechanisch stabile und gleichzeitig dynamische Strukturen ausbilden können.
Forschungsförderung
Die Arbeit wurde von der Deutschen Forschungsgemeinschaft gefördert.
Originalpublikation
Lukas Windgasse und Carsten Grashoff. A conformational change in α-catenin’s actin-binding domain governs adherens junction maturation. Commun Biol 8, 1325 (2025). DOI: 10.1038/s42003-025-08785-3