Mikrobielle Polythioester
Polythioester - eine neue Klasse von Biopolymeren
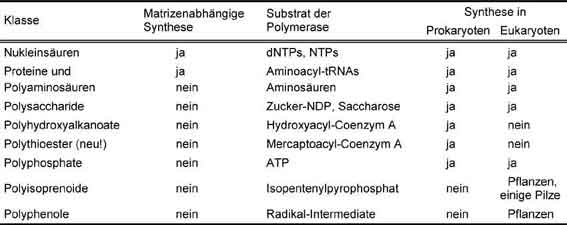
Viele Mikroorganismen sind in der Lage, wasserunlösliche Polyester als Speicherstoffe in den Zellen zu akkumulieren. Bei diesen Einschlüssen handelt es sich um Polyhydroxyalkanoate (PHA), die thermoplastisch verformbar sind und als "Bioplastik" verschiedenartige technische Anwendungen finden, wie z. B. als kompostierbares Verpackungsmaterial. Auf der Suche nach neuen interessanten Materialien wurde in diesem Arbeitskreis eine bisher unbekannte Klasse von Biopolymeren synthetisiert: Polythioester (PTE). Die einzigen bisher bekannten Biopolymere, die Schwefel enthalten, sind Proteine und einige komplexe Polysaccharide; sie enthalten Schwefel jedoch nur in den Seitenketten, nicht im Polymerrückgrat.Tabelle 1 Acht Klassen von Biopolymeren. |
 |
Polythioester aus Ralstonia eutropha
 |
Abb. 1 A) PHA-Speicherung in Ralstonia eutropha. B) PHAs als Verpackungsmaterial. |
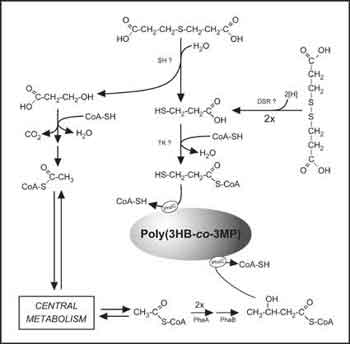 |
Abb. 2 Biosynthese von PTEs in Ralstonia eutropha. Abkürzungen: 3HB, 3-Hydroxybutyrat; 3MP, 3-Mercaptopropionat; SH, Sulfid-Hydrolase; DSR, Disulfid-Reduktase; TK, Thiokinase; PhaA, Ketothiolase; PhaB, Acetoacetyl-CoA-Reductase; PhaC, PHA Synthase. |
Zur Biosynthese von PTEs kann R. eutropha nicht nur 3MP als Vorstufe nutzen, sondern auch andere Substrate wie 3,3' Thiodipropionsäure (TDP) oder 3,3 Dithiodipropionsäure (DTDP). Welche Abbauwege und Enzyme an diesen Umsetzungen beteiligt sind, ist Gegenstand aktueller Forschungsarbeiten.
Polythioester aus Escherichia coli - der BPEC-Prozess
Da die Bereitstellung von 3HB-CoA in R. eutropha ausgehend von Acetyl CoA nicht unterdrückt werden kann, enthalten diese PTEs stets einen Anteil von mindestens 25 mol% an 3HB. Deshalb wurde ein neues Verfahren zur Produktion von Homopolythioestern entwickelt. Dazu wird ein rekombinanter Stamm von Escherichia coli eingesetzt, der durch die Expression von drei Genen unterschiedlicher Herkunft zu einem "künstlichen" PHA-Biosyntheseweg befähigt ist, der so nicht in der Natur vorkommt. Bei Zugabe der entsprechenden 3-Mercaptofettsäure wird das Vorstufensubstrat in die Zelle aufgenommen, durch eine Butyratkinase (Buk) phosphoryliert und anschließend durch eine Phosphotransbutyrylase (Ptb) in den entsprechenden CoA-Thioester überführt, der dann durch die PHA-Synthase (PhaEC) polymerisiert wurde. Durch diesen BPEC-Prozess können verschiedene PTEs hergestellt werden, die ausschließlich 3MP, 3MB oder 3MV enthalten.Biotechnologische Produktion von Polythioestern
Um die physikalischen Eigenschaften von PTEs zu ermitteln und somit Aussagen über mögliche technische Anwendungen machen zu können, müssen ausreichende Mengen dieses neuen Biomaterials produziert werden. Dazu werden die im Biotechnikum des Instituts zur Verfügung stehenden Bioreaktoren mit einem Volumen von bis 650 Litern eingesetzt. Die Etablierung des BPEC-Prozesses im technischen Maßstab und eine optimierte Isolierungsmethode ermöglichen die Synthese von PTEs im Kilogramm-Maßstab.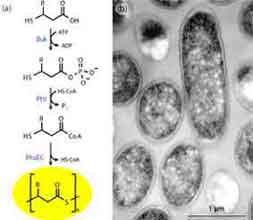 |  |
|
|
Biologischer Abbau von Polythioestern
Einer der wichtigsten Eigenschaften von technisch relevanten Materialien ist die biologische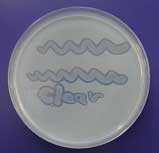 |
Abb. 5 Bildung von Klärhöfen um Kolonien von Poly(3HB co 3MP)- abbauenden Bakterien. |
Ausgehend von unterschiedlichen Naturproben wie z. B. Komposterde, wurden verschiedene Bakterien isoliert, die Poly(3HB co 3MP) hydrolysieren können. Dabei wurde unter anderem ein neuartiges thermophiles Bakterium entdeckt: Schlegelella thermodepolymerans gen. nov. sp. nov.
Biochemische Untersuchungen zeigten, dass die extrazelluläre PHA-Depolymerase aus diesem Bakterium sowie andere bekannte PHA-Depoylmerasen nur das Copolymer Poly(3HB co 3MP) sowie Poly(3HB), nicht aber die Homopolythioester hydrolysieren können. Dies zeigt, dass PHA-Depolymerasen spezifisch für Polyoxoester sind; die Spaltung von Thioesterbindungen wird nicht durch diesen Enzymtyp katalysiert.
Zur Zeit werden verschiedene Screening-Methoden verwendet, um neue aerobe und anaerobe Mikroorganismen zu isolieren, die PTE-Homopolymere abbauen können.
Stichwörter
Biopolymere, Polythioester, PTE, 3-Mercaptopropionsäure, 3-Mercaptobuttersäure, 3-Mercaptovaleriansäure, 3,3'-Thiodipropionsäure, 3,3-Dithiodipropionsäure, Poly(3HB-co-3MP), Poly(3HB-co-3MB), Poly(3MP), PMP, Poly(3MB), PMB, Poly(3MV), PMV, Polyhydroxyalkanoate, PHA, Ralstonia eutropha, BPEC-Prozess, Biologischer Abbau, Schlegelella thermodepolymerans| Am Projekt beteiligte Mitarbeiter | Koorperationspartner, Förderung, Finanzierung | |
| Zur Zeit: Früher: | Nadine Bruland Khaled Elbanna Do Young Kim Alexander Steinbüchel Jan Hendrik Wübbeler Christian Ewering Tina Lütke-Eversloh Uwe Remminghorst Nehalkumar Thakor | Westfälische Wilhelms-Universität Münster |
Publikationen
I Publications in peer reviewed journals (original contributions)
- Kim, D. Y., K. Elbanna, N. Thakor, T. Lütke-Eversloh, and A. Steinbüchel. 2005. Poly(3-mercaptopropionate): A non-biodegradable biopolymer? Biomacromolecules 6:897-901.
- Thakor, N., T. Lütke-Eversloh, and A. Steinbüchel. 2005. Application of the BPEC pathway for large scale biotechnological production of poly(3-mercptopropionate) by recombinant Escherichia coli including a novel in situ isolation method. Appl. Environ. Microbiol. 71:835-841.
- Lütke-Eversloh, T., K. Elbanna, M. C. Cnockaert, J. Mergaert, J. Swings, C. M. Manaia, and A. Steinbüchel. 2004. Reclassification of Caenibacterium thermophilum is a later synonym of Schlegelella thermodepolymerans. Int. J. System. Evol. Microbiol. 54:1933-1935.
- Elbanna, K., T. Lütke-Eversloh, D. Jendrossek, H. Luftmann, and A. Steinbüchel. 2004. Studies on the biodegradability of polythioesters by polyhydroxyalkanoate (PHA) degrading bacteria and PHA depolymerases. Arch. Microbiol. 182:212-225.
- Elbanna, K., T. Lütke-Eversloh, S. Van Trappen, J. Mergaert, J. Swings, and A. Steinbüchel. 2003. Schlegelella thermodepolymerans gen. nov., sp. nov., a novel thermophilic bacterium that degrades poly(3 hydroxybutyrate-co-3 mercaptopropionate). Int. J. Syst. Evol. Microbiol. 53:1165-1168.
- Kawada, J., T. Lütke-Eversloh, A. Steinbüchel, and R. H. Marchessault. 2003. Physical properties of microbial polythioesters: Characterization of poly(3 mercaptoalkanoates) synthesized by engineered Escherichia coli. Biomacromolecules, 4:1698-1702.
- Liu, S.-J., T. Lütke-Eversloh, and A. Steinbüchel. 2003. Biosynthesis of poly(3 mercaptopropionate) and poly(3-meraptopropionate-co-3-hydroxybutyrate) with recombinant Escherichia coli. Chin. J. Biotechnol. 19:195-199.
- Lütke-Eversloh, T., and A. Steinbüchel. 2003. Novel precursor substrates for polythioesters (PTE) and limits of PTE biosynthesis in Ralstonia eutropha. FEMS Microbiol. Lett. 221:191-196.
- Lütke-Eversloh, T., A. Fischer, U. Remminghorst, J. Kawada, R. H. Marchessault, A. Bögershausen, M. Kalwei, H. Eckert, R. Reichelt, S.-J. Liu, and A. Steinbüchel. 2002. Biosynthesis of novel thermoplastic polythioesters by engineered Escherichia coli. Nature Materials 1:236-240.
- Lütke-Eversloh, T., J. Kawada, R. H. Marchessault, and A. Steinbüchel. 2002. Characterization of biological polythioesters: Physical properties of novel copolymers synthesized by Ralstonia eutropha. Biomacromolecules 3:159-166.
- Lütke-Eversloh, T., K. Bergander, H. Luftmann, and A. Steinbüchel. 2001. Biosynthesis of poly(3-hydroxybutyrate-co-3-mercaptobutyrate) as a sulfur analogue to poly(3-hydroxybutyrate) (PHB). Biomacromolecules 2:1061-1065.
- Lütke-Eversloh, T., K. Bergander, H. Luftmann, and A. Steinbüchel. 2001. Biosynthesis of a new class of biopolymer: bacterial synthesis of a sulfur containing polymer with thioester linkages. Microbiology 147:11-19.
II Other original contributions
- Lütke-Eversloh, T., A. Steinbüchel, and C. Ewering. 2000. Sulphur containing polyhydroxyalkanoate compositions and method of production. US patent no. 60/226,139.
III Review articles in peer reviewed journals or books
- Lütke-Eversloh, T., and A. Steinbüchel. 2005. Polythioesters. In: Biotechnology of Biopolymers - From Synthesis to Patents Vo. 2 (Steinbüchel, A. & Doi, Y., Eds.), Wiley-VCH Weinheim, pp. 1063-1080.
- Lütke-Eversloh, T., and A. Steinbüchel. 2004. Microbial polythioesters. Macromol. Bioscience, 4:165-174.
- Lütke-Eversloh, T., and A. Steinbüchel. 2003. Polythioesters. In: Biopolymers Vol. 9 (Matsumura, S. & Steinbüchel, A., Eds.), Wiley-VCH Weinheim, pp. 63-80.

