Gärungsstoffwechsel aerober Bakterien
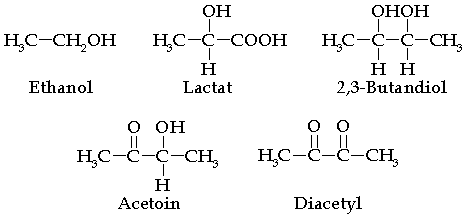
Das aerobe, über einen strikt respiratorischen Energiestoffwechsel verfügende Bakterien auch einen Gärungsstoffwechsel besitzen, wurde in den 70er Jahren von Vollbrecht und Schlegel (Eur. J. Appl. Microbiol. Biotechnol. 6: 157-166, 1978; J. Gen. Microbiol. 117:475-481, 1980) überraschend in Ralstonia eutropha gefunden. Bei der Kultivierung von R. eutropha und anderer Bakterien unter Sauerstoffmangelbedingungen schieden die Zellen Alkohole wie z.B. Ethanol, Acetoin und 2,3-Butandiol sowie organische Säuren wie z.B. Lactat, Acetat und Intermediate des Citronensäurezyklus ins Medium aus. Parallel hierzu wurde die Synthese typischer Gärungsenzyme wie Lactat-Dehydrogenase, Alkohol-Dehydrogenase und 2,3-Butandiol-Dehydrogenase induziert.Neben R. eutropha besitzen zahlreiche andere aerobe Bakterien wie z.B. Pseudomonas sp. Rhodococcus opacus, Xanthobacter autotrophicus und Flexibacter elegans bei Sauerstoffmangel einen Gärungsstoffwechsel. In R. eutropha wurden die Bedingungen zur optimalen Synthese der Gärungsenzyme im Detail untersucht. Es wurde eine Korrelation mit der 'Relativen Respirationsrate' (RRR) hergestellt. Dieser Parameter beschreibt die den Zellen auf Grund des aufoktruierten Sauerstoffmangels noch mögliche Atmungsrate. Die Lactat-Dehydrogenase und eine multifunktionelle Alkohol-Dehydrogenase (mit Ethanol, 2.3-Butandiol- und Acetaldehyd-Dehydrogenase Aktivitäten) aus R. eutropha wurden bis zur Homogenität gereinigt und biochemisch charakterisiert. Für die Lactat-Dehydrogenase wurde Oxalacetat als äußerst potenter Inhibitor (Ki ~ 50 nM) identifiziert. Die Gene dieser beiden Gärungsenzyme (ldh und adh) wurden kloniert und molekulargenetisch charakterisiert.
Aus diesem Forschungsprojekt entwickelten sich später zwei neue Forschungsprojekte (Nr. 1 "Mikrobielle Polyester" und Nr. 9 "Katabolismus von Acetoin").
Methoden und Strategien
Physiologische Untersuchungen verbunden mit dem Nachweis der ausgeschiedenen Stoffwechselprodukte sowie der Enzyme und die Kultivierung der Bakterien unter genau definierten Sauerstoffmangelbedingungen bildeten die Grundlage für dieses Projekt. Später wurden die Gärungssysteme unter Einbeziehung von affinitätschromatographischen Methoden gereinigt, und es wurden detaillierte kinetische Untersuchungen und Inhibitatorstudien durchgeführt.Zur Identifizierung des ADH Strukturgens wurden zunächst Mutanten isoliert, die im Gegensatz zum Wildtyp Ethanol und 2,3-Butandiol durch konstitutiv exprimierte ADH als Kohlenstoffquelle verwerten konnten. Von diesen Primärmutanten wurden dann Tn5-induzierte Sekundärmutanten isoliert, die diese Fähigkeit wieder verloren hatten aber ein durch Transposoninsertion markiertes und damit leicht identifizierbares Strukturgen der ADH aufwiesen. Das Strukturgen der LDH wurde nach Ermittlung der N-terminalen Sequenz des gereinigten Enzyms mit Hilfe spezifischer Oligonukleotide durch Hybridisierung identifiziert.
Durch 'metabolic engineering' wurde in einer KDPG-Aldolase negativen Mutante von R. eutropha durch Expression des Gens für Phosphofructokinase aus E. coli die Glykolyse etabliert. Obwohl die rekombinanten Stämme pro Fructosemolekül nun doppelt soviel ATP gewinnen konnten, konnten auch diese unter anaeroben Bedingungen nicht wachsen.
Stichwörter
ADH, Alkohol Dehydrogenase, 2,3-Butandiol Dehydrogenase, Flexibacter elegans, Gärungsenzyme, KDPG-Aldolase, Lactat Dehydrogenase, LDH, Metabolic engineering, Pseudomonas sp., Ralstonia eutropha, Relative Respirationsrate, Rhodococcus opacus, Sauerstoffmangel, Xanthobacter autotrophicus| Am Projekt beteiligte
Mitarbeiter |
Koorperationspartner, Förderung, Finanzierung | |
| Früher: | Claudia Fründ Dieter Jendrossek Niels Krüger Michael Kuhn Matthias Niedrig Hans-Günther Schlegel Alexander Steinbüchel |
Die Untersuchungen wurden über mehrere Jahre von der Deutschen Forschungsgemeinschaft (DFG) gefördert (Ste 386-X). |
Literatur
I Publications in peer reviewed journals (original contributions)
- Jendrossek, D., H. D. Kratzin and A. Steinbüchel. 1993. The Alcaligens eutrophus ldh structural gene encodes a novel type of lactate dehydrogenase. FEMS Microbiol. Lett. 112:229-236.
- Jendrossek, D., N. Krüger, A. Steinbüchel. 1990. Characterization of alcohol dehydrogenase genes of derepressible wild type Alcaligenes eutrophus H16 and of constitutive mutants. J. Bacteriol. 172:4844-4851.
- Jendrossek, D., A. Steinbüchel, and H. G. Schlegel. 1988. Alcohol dehydrogenase from Alcaligenes eutrophus: subcloning, heterologous expression in Escherichia coli, sequencing and location of Tn5 insertions. J. Bacteriol. 170:5248-5256.
- Kuhn, M., D. Jendrossek, C. Fründ, A. Steinbüchel and H. G. Schlegel. 1988. Cloning of the Alcaligenes eutrophus alcohol dehydrogenase gene. J. Bacteriol. 170:685-692.
- Steinbüchel, A., C. Fründ, D. Jendrossek, and H. G. Schlegel. 1987. Isolation of mutants of Alcaligenes eutrophus unable to derepress the fermentative alcohol dehydrogenase. Arch. Microbiol. 148:178-186.
- Steinbüchel, A. 1986. Expression of the Escherichia coli pfkA gene in Alcaligenes eutrophus and other gram-negative bacteria. J. Bacteriol. 166:319-327.
- Kuhn, M., A. Steinbüchel, and H. G. Schlegel. 1984. Hydrogen evolution by strictly aerobic hydrogen bacteria under anaerobic conditions. J. Bacteriol. 159:633-639.
- Steinbüchel, A. and H. G. Schlegel. 1984. A multifunctional fermentative alcohol dehydrogenase from the strict aerobe Acaligenes eutrophus: purification and properties. Eur. J. Biochem. 141:555-564.
- Steinbüchel, A., M. Kuhn, M. Niedrig, and H. G. Schlegel. 1983. Fermentation enzymes in strictly aerobic bacteria: comparative studies on strains of the genus Alcaligenes and on Nocardia opaca and Xanthobacter autotrophicus. J. Gen. Microbiol. 129:2825-2835.
- Steinbüchel, A. and H. G. Schlegel. 1983. The rapid purification of lactate dehydrogenase from Alcaligenes eutrophus in a two-step procedure. Eur. J. Appl. Microbiol. Biotechnol. 17:163-167.
- Steinbüchel A. and H. G. Schlegel. 1983. NAD-linked L(+)-lactate dehydrogenase from the strict aerobe Alcaligenes eutrophus. 2. Kinetic properties and inhibition by oxaloacetate. Eur. J. Biochem. 130:329-334.
- Steinbüchel A. and H. G. Schlegel. 1983. NAD-linked L(+)-lactate dehydrogenase from the strict aerobe Alcaligenes eutrophus. Purification and properties. Eur. J. Biochem. 130:321-328.
II Other original contributions
- Schlegel, H. G. and A. Steinbüchel. 1981. Die relative Respirationsrate (RRR), ein neuer Belüftungsparameter. In: R. M. Lafferty (ed.) Fermentation. Springer Verlag, Wien 1981, pp. 11-26.
III Review arcticles in peer reviewed journals or books
none
IV Other review articles
none

