Katabolismus von Acetoin
 Acetoin ist ein Produkt des fermentativen Metabolismus vieler prokaryotischer und eukaryotischer Mikroorganismen einschließlich von Spezies der Gattung Bacillus. Seit 75 Jahren ist bekannt, daß Bakterien befähigt sind, Acetoin als alleinige Kohlenstoffquelle zum Wachstum zu nutzen. Detailliertes Wissen über den Katabolismus von Acetoin wurde durch Studien bei einer Vielfalt Acetoin-verwertender Bakterien wie Pelobacter carbinolicus, Clostridium magnum, Ralstonia eutropha (früher Alcaligenes eutrophus), Pseudomonas putida und Bacillus subtilis gewonnen. In jenen Bakterien wird der Acetoinkatabolismus durch das Acetoin-Dehydrogenase-Enzymsystem (AoDH ES) eingeleitet, welches aus drei Enzymen besteht: Einer Thiamin-PPi-abhängigen Acetoin-Dehydrogenase (E1), einer Dihydrolipoamid-Acetyltransferase (E2) und einer Dihydrolipoamid-Dehydrogenase (E3). Dieses Enzymsystem katalysiert die Spaltung von Acetoin in Acetaldehyd und Acetyl-CoA. Die Proteine des AoDH ES wurden gereinigt und biochemisch charakterisiert.Die Strukturgene des AoDH ES acoA (kodierend für die a-Unterheinheit von E1), acoB (E1 b) und acoC (E2) wurden zusammenhängend und in kolinearer Orientierung in den Genomen der oben erwähnten Bakterien gefunden. In P. carbinolicus, C. magnum und B. subtilis ist auch das acoL-Gen (E3) Teil der aco Gengruppe. Aufgrund der biochemischen Daten und der Genorganisation ähnelt das AoDH ES sehr dem Pyruvat-Dehydrogenase-Multienzymkomplex und den Dehydrogenase-Multienzymkomplexen, die die Decarboxylierung anderer 2-Ketosäuren katalysieren.
Acetoin ist ein Produkt des fermentativen Metabolismus vieler prokaryotischer und eukaryotischer Mikroorganismen einschließlich von Spezies der Gattung Bacillus. Seit 75 Jahren ist bekannt, daß Bakterien befähigt sind, Acetoin als alleinige Kohlenstoffquelle zum Wachstum zu nutzen. Detailliertes Wissen über den Katabolismus von Acetoin wurde durch Studien bei einer Vielfalt Acetoin-verwertender Bakterien wie Pelobacter carbinolicus, Clostridium magnum, Ralstonia eutropha (früher Alcaligenes eutrophus), Pseudomonas putida und Bacillus subtilis gewonnen. In jenen Bakterien wird der Acetoinkatabolismus durch das Acetoin-Dehydrogenase-Enzymsystem (AoDH ES) eingeleitet, welches aus drei Enzymen besteht: Einer Thiamin-PPi-abhängigen Acetoin-Dehydrogenase (E1), einer Dihydrolipoamid-Acetyltransferase (E2) und einer Dihydrolipoamid-Dehydrogenase (E3). Dieses Enzymsystem katalysiert die Spaltung von Acetoin in Acetaldehyd und Acetyl-CoA. Die Proteine des AoDH ES wurden gereinigt und biochemisch charakterisiert.Die Strukturgene des AoDH ES acoA (kodierend für die a-Unterheinheit von E1), acoB (E1 b) und acoC (E2) wurden zusammenhängend und in kolinearer Orientierung in den Genomen der oben erwähnten Bakterien gefunden. In P. carbinolicus, C. magnum und B. subtilis ist auch das acoL-Gen (E3) Teil der aco Gengruppe. Aufgrund der biochemischen Daten und der Genorganisation ähnelt das AoDH ES sehr dem Pyruvat-Dehydrogenase-Multienzymkomplex und den Dehydrogenase-Multienzymkomplexen, die die Decarboxylierung anderer 2-Ketosäuren katalysieren. 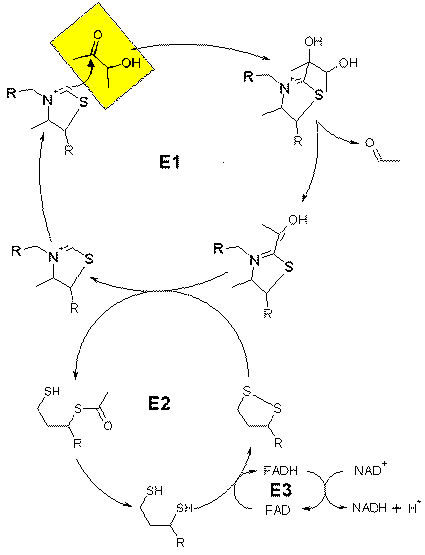
Die Studien am AoDH ES veranlaßten uns, den Pyruvat- und den 2-Ketoglutarat-Dehydrogenase-Multienzymkomplex in R. eutropha in vergleichender Weise zu untersuchen.
Methoden und Strategien
Die folgenden Methoden sind von uns während der Untersuchungen zum Katabolismus von Acetoin verwendet worden.- Reinigung und Charakterisierung von Enzymen
- Immunologische Methoden (z. B. Ouchterlony)
- Gaschromatographische Bestimmung von Metaboliten und Reaktionsprodukten des AoDH ES
- Hybridisierung mit Biotin-markierten DNA-Sonden, um Gene zu klonieren
- DNA Sequenzierung
- Heterologe Expression in Escherichia coli
Stichwörter
Acetoin, Acetoin:DCPIP-Oxidoreductase, Acetoin-Dehydrogenase, Acetoin-Dehydrogenase-Enzymsystem, aco Gene, Bacillus subtilis, 2,3-Butandiol, 2,3-Butandion, Clostridium magnum, Diacetyl, Dihydrolipoamid-Dehydrogenase, Dihydrolipoamid-Acetyltransferase, 2-Hydroxy-3-Butanon, Pelobacter carbinolicus, Pseudomonas putida, Ralstonia eutropha| Am Projekt beteiligte
Mitarbeiter |
Koorperationspartner, Förderung, Finanzierung | |
| Früher: | Claudia Fründ Silke Hein Min Huang Niels Krüger Heidrun Lorenzl Fred Bernd Oppermann-Sanio Horst Priefert Alexander Steinbüchel Karin Zeh |
Die Untersuchungen wurden über mehrere Jahre von der Deutschen Forschungsgemeinschaft (DFG) gefördert. |
Literatur
I Publications in peer reviewed journals (original contributions)
- Min Huang, F. B. Oppermann, and A. Steinbüchel. 1999. Biochemical and molecular characterization of the Bacillus subtilis acetoin catabolic pathway. J. Bacteriol. 181:3837-3841.
- Hein, S. and A. Steinbüchel. 1996. Cloning and characterization of the Alcaligenes eutrophus 2-oxoglutarate dehydrogenase complex. FEMS Microbiol. Lett. 136:231-238.
- Hein, S., and A. Steinbüchel. 1996. Alcaligenes eutrophus possesses a second pyruvate dehydrogenase (E1). Eur. J. Biochem. 237:674-684.
- Huang, M., F. B. Oppermann, and A. Steinbüchel. 1994. Molecular characterization of the Pseudomonas putida 2,3-butanediol-catabolic pathway. FEMS Microbiol. Lett. 124:141-150.
- Hein, S., and A. Steinbüchel. 1994. Biochemical and molecular characterization of the Alcaligenes eutrophus pyruvate dehydrogenase complex and identification of a new type of dihydrolipoamide dehydrogenase. J. Bacteriol. 176:4394-4408.
- Krüger, N., F. B. Oppermann, H. Lorenzl and A. Steinbüchel. 1994. Biochemical and molecular characterization of the Clostridium magnum acetoin dehydrogenase enzyme system. J. Bacteriol. 176:3614-3630.
- Oppermann, F. B., and A. Steinbüchel. 1994. Identification and molecular characterization of the aco genes encoding the Pelobacter carbinolicus acetoin dehydrogenase enzyme system. J. Bacteriol. 176:469-485.
- Priefert, H., and A. Steinbüchel. 1993. Overproduction of a stable acetaldehyde dehydrogenase with high affinity to acetaldehyde by Escherichia coli expressing the acoD gene of Alcaligenes eutrophus. Biotechnol. Lett. 15:443-448.
- Lorenzl, H., F. B. Oppermann, B. Schmidt and A. Steinbüchel. 1993. Purification and characterization of the E1 component of the Clostridium magnum acetoin:DCPIP oxidoreductase enzyme system. Ant. v. Leeuwenhoek 64:9-15.
- Priefert, H., and A. Steinbüchel. 1992. Identification and molecular characterization of the acetyl-coenzyme A synthetase gene (acoE) of Alcaligenes eutrophus. J. Bacteriol. 174:6590-6599.
- Krüger, N., and A. Steinbüchel. 1992. Identification of (acoR): a regulatory gene for the expression of genes essential for acetoin catabolism in Alcaligenes eutrophus H16. J. Bacteriol. 174:4391-4400.
- Priefert, H., N. Krüger, D. Jendrossek, B. Schmidt and A. Steinbüchel. 1992. Identification and molecular characterization of the gene for acetaldehyde dehydrogenase II (acoD) from Alcaligenes eutrophus. J. Bacteriol. 174:899-907.
- Priefert, H., Hein, S., Krüger, N., Zeh, K., Schmidt, B. and A. Steinbüchel. 1991. Identification and molecular characterization of the Alcaligenes eutrophus H16 aco operon involved in acetoin catabolism. J. Bacteriol. 173:4056-4071.
- Oppermann, F. B., B. Schmidt, and A. Steinbüchel. 1991. Purification and characterization of acetoin:DCPIP oxidoreductase, dihydrolipoamide dehydrogenase and dihydrolipoamide acetyltransferase of the Pelobacter carbinolicus acetoin dehydro-genase system. J. Bacteriol. 173:757-767.
- Jendrossek, D., N. Krüger, A. Steinbüchel. 1990. Characterization of alcohol dehydrogenase genes of derepressible wild type Alcaligenes eutrophus H16 and of constitutive mutants. J. Bacteriol. 172:4844-4851.
- Fründ, C., H. Priefert, A. Steinbüchel, and H. G. Schlegel. 1989. Biochemical and genetic analysis of acetoin catabolism in Alcaligenes eutrophus. J. Bacteriol. 171:6539-6548.
- Oppermann, F. B., A. Steinbüchel, and H. G. Schlegel. 1989. Evidence for oxidative-thiolytic cleavage of acetoin in Pelobacter carbinolicus analogous to aerobic oxidative decarboxylation of pyruvate. FEMS Microbiol. Lett. 60:113-118.
- Oppermann, F. B., A. Steinbüchel, and H. G. Schlegel. 1988. Utilization of methylacetoin by the strict anaerobe Pelobacter carbinolicus and consequences for the catabolism of acetoin. FEMS Microbiol. Lett. 55:47-52.
- Kuhn, M., D. Jendrossek, C. Fründ, A. Steinbüchel and H. G. Schlegel. 1988. Cloning of the Alcaligenes eutrophus alcohol dehydrogenase gene. J. Bacteriol. 170:685-692.
- Jendrossek, D., A. Steinbüchel, and H. G. Schlegel. 1987. Three different proteins exhibiting NAD-dependent acetaldehyde dehydrogenase activity from Alcaligenes eutrophus. Eur. J. Biochem. 167:541-548.
- Steinbüchel, A., C. Fründ, D. Jendrossek, and H. G. Schlegel. 1987. Isolation of mutants of Alcaligenes eutrophus unable to derepress the fermentative alcohol dehydrogenase. Arch. Microbiol. 148:178-186.
- Steinbüchel, A. and H. G. Schlegel. 1984. A multifunctional fermentative alcohol dehydrogenase from the strict aerobe Acaligenes eutrophus: purification and properties. Eur. J. Biochem. 141:555-564.
II Other original publications
none
III Review articles in peer reviewed journals or books
none
IV Other review articles
- Steinbüchel, A., S. Hein, M. Huang, N. Krüger and F. B. Oppermann. 1996. Biochemistry and molecular genetics of bacterial TPP-dependent acetoin dehydrogenases. In: H. Bisswanger and A. Schellenberger (Eds.) Biochemistry and Physiology of Thiamin Diphosphate Enzymes, Wissenschaftlicher Verlag A. u. C. Intemann, Prien, pp. 586-599.

