Killerhefen
Einleitung
Unter den Hefen existieren einige Stämme, die Konkurrenten der eigenen Art, aber auch andere Spezies, durch ins Wachstumsmedium sekretierte Proteintoxine töten (Abb. 1).
Killerhefen
Einleitung
Unter den Hefen existieren einige Stämme, die Konkurrenten der eigenen Art, aber auch andere Spezies, durch ins Wachstumsmedium sekretierte Proteintoxine töten (Abb. 1).
Abb. 1: Eine Killerhefe verhindert das Wachstum sensitiver Zellen durch Sekretion eines Toxins.
Die Gene für die Toxine können auf den Hefechromosomen, aber auch auf dsRNA (virus-like particles, VLPs), oder auf der dsDNA von Virus-ähnlichen Elementen (virus-like elements, VLEs) lokalisiert sein (Abb. 2). Wir untersuchen die Toxine aus der letztgenannten Gruppe: Es sind hier vier Killerhefen bekannt (s. Tabelle 1).

Abb. 2: Genomische Organisation der VLEs pPac1-1 und pPac1-2 aus Pichia acaciae. ORFs sind als Pfeile angegeben. Schwarze Dreiecke: terminale inverse Repititionen (TIR), schwarze Kreise: terminale Proteine (TP), SSB: Einzelstrangbindeprotein, TRF: Terminaler Erkennungsfaktor, (Abb. verändert nach Klassen & Meinhardt, 2007).
Tabelle 1: Hefen mit VLE-vermitteltem Killerphänotyp.
| Killer Stamm | Toxin | VLEs | Größe | Referenzen |
| Kluyveromyces lactis | Zymocin | pGKL1 pGKL2 |
8,9 kb 13,5 kb |
Gunge et al., 1981 Lu et al., 2005 |
| Pichia acaciae | PaT | pPac1-2 pPac1-1 |
6,8 kb 13,6 kb |
Worsham & Bolen, 1990 Klassen et al., 2004 Klassen et al., 2008 Jeske & Meinhardt, 2006 |
| Debaryomyces robertsiae | DrT | pWR1A pWR1B |
8,0 kb 14,6 kb |
Cong et al., 1994 Klassen & Meinhardt, 2002 |
| Pichia inositovora | PiT | pPin1-3 pPin1-2 pPin1-1 |
10 kb 13 kb 18 kb |
Hayman & Bolen, 1991 Klassen & Meinhardt, 2003 Kast et al., 2014 |
Struktur der VLEs
VLEs (ursprünglich als lineare Plasmide bezeichnet) sind im Cytoplasma lokalisiert. Da die Replikations- und Transkriptionsmaschinerie im Kern vorliegt, müssen VLEs ihre Replikation und Transkription kernunabhängig selbst bewerkstelligen. Sie besitzen auf den größeren und in allen Hefen hoch konservierten Elementen alle für die autonome cytoplasmatische Replikation notwendigen genetischen Informationen, u. a. kodieren sie für eine DNA-Polymerase, eine RNA-Polymerase, eine Helikase und Einzelstrangbindeproteine (siehe Abb. 2). Einige dieser Proteine sowie auch der Replikationsmechanismus zeigen Ähnlichkeiten zu den Adenoviren und deuten damit auf den viralen Ursprung dieser DNA-Elemente hin. Die kleineren VLEs sind auf die großen Elemente angewiesen und ihre Sequenz ist in allen Hefen sehr variabel; sie kodieren die Untereinheiten der Toxine sowie die zugehörige Immunität.
Der Immunitätsfaktor schützt die Zellen vor dem jeweiligen Exotoxin; eine Kreuzresistenz gegen andere Toxine konnte bisher nicht festgestellt werden. Der Mechanismus der Immunitätsvermittlung ist bisher nicht aufgeklärt. Zusammen mit den Toxinen sichern die Immunitätsproteine die Autoselektion der VLEs, denn sobald eine Zelle ihre VLEs und damit auch die Immunität verliert, wird sie durch die Toxine benachbarter Zellen getötet (Satwika et al., 2012).
Toxinstruktur
Die VLE kodierten Toxine sind heteromere Proteinkomplexe; dabei ist eine der Untereinheiten bei allen Toxinen hoch konserviert und hat eine Chitinase Funktion. Dieses Protein erkennt das Chitin der Zielzellen und bewirkt gemeinsam mit einer stark hydrophoben Untereinheit das Einbringen der eigentlich toxischen Untereinheit in die Zielzelle.
Die toxische Untereinheit des Zymocin von K. lactis zeigt kaum Sequenzhomologien zum PiT von P. inositovora und überhaupt keine zum PaT von P. acaciae. Das entsprechende Protein des D. robertsiae Toxins weist eine deutlich erkennbare Homologie zu PaT auf, jedoch keine zum Zymocin.
Der molekulare Mechanismus der Toxizität
Der toxische Mechanismus wurde für Zymocin und durch uns für PaT untersucht. Nach der Bindung an das Chitin der Zielzelle, das wie beim Zymocin als primärer Toxinrezeptor fungiert, hilft eine hydrophobe Domäne beim Transport der eigentlich toxischen Untereinheit ins Zellinnere. Während es beim Zymocin zum Zellzyklusarrest in der G1-Phase kommt, bewirkt PaT einen S-Phase Arrest (Schaffrath & Meinhardt, 2005; Stark et al., 1990).
Um das intrazelluläre Target von Zymocin zu finden, wurde die toxische Untereinheit mit Hilfe eines induzierbaren Promoters in Hefe-Transposonmutanten exprimiert und auf diese Weise Zymocin-resistente Elongator (elp3) Mutanten gefunden. Da Elp3 unter anderem eine wichtige Rolle bei der tRNA-Modifikation spielt, war dies ein Hinweis, dass tRNAs das Target sein könnten. Und tatsächlich konnte eine Überexpression von tRNAE vor der toxischen Aktivität des Zymocin schützen und eine heterologe Expression der Zymocin γ-Untereinheit führte zur Verminderung des tRNAE Level in der Zelle. In vitro wurde die Schnittstelle innerhalb der tRNAE zwischen Position 34 und 35 in der Antikodonschleife bestimmt (Lu et al., 2005; Jablonowski et al., 2006).
Für PaT konnte tRNAQ als intrazelluläres Target identifiziert werden. Eine Besonderheit an PaT ist, dass es zweifach innerhalb der Antikodonschleife schneidet, nämlich zwischen den Uridinen an Position 34 und 35 und ein zweites Mal zwei Nukleotide 5´-stromaufwärts zwischen Position 32 und 33 (Klassen et al., 2008) (s. Abb. 3).
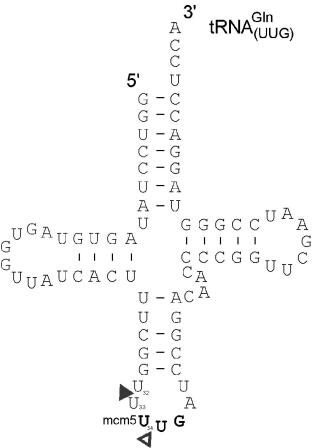
Abb. 3: Sekundärstruktur der tRNAGln. Durch Pfeile gekennzeichnet sind die Schnittstellen (Δ) und (▲) von PaT innerhalb der Antikodonschleife.
Erst kürzlich haben wir den molekularen Wirkmechanismus des Killertoxins PiT von P. inositovora aufgeklärt (Kast et al., 2014). PiT führt zur Fragmentierung der 25S und 18S rRNA (Abb. 4A), wobei die letztere an mindestens drei Positionen in den Bereichen um 130 nt, 700 nt und 1100 nt geschnitten wird. Durch ortsgerichtete Mutagenese konnte für die Aminosäurereste E9 und H214, die in allen Toxinen konserviert und für Zymocin und PaT als katalytisch identifiziert wurden (Keppetipola et al., 2009; Jain et al., 2011; Meineke et al., 2012), eine essentielle Rolle, die mit der rRNA Fragmentierung korreliert, ebenfalls bestätigt werden. Interessanterweise liegen die Schnittstellen des 130 nt Fragments der 18S rRNA in einer Schleife mit ähnlicher Nukleotidabfolge wie in der Anticodonschleife von tRNAGlu, dem Target von Zymocin (Abb. 4B). Obwohl die toxischen Untereinheiten von PiT und Zymocin kaum Sequenzähnlichkeiten aufweisen, bestehen Gemeinsamkeiten zum Zymocin und zum PaT: z.B. die genetische Kodierung auf VLEs und der heteromere Aufbau aus einer variablen, intrazellulär aktiven toxischen und einer konservierten Chitin-bindenden Transportuntereinheit. Trotz unterschiedlicher molekularer Targets und fehlender Homologien, lässt sich daher ein gemeinsamer evolutionärer Ursprung vermuten (Kast et al., 2014).
Abb. 4: A. Fragmentierung von rRNA nach intrazellulärer Expression von PiT (PiOrf4) in Saccharomyces cerevisiae. B. 18S rRNA Region mit den Schnittstellen bei ~130 nt (▲) von PiT. Zum Vergleich: Anticodonschleife der tRNAGlu(UUC) mit markierter Schnittstelle (▲) für Zymocin.
Was wir aktuell machen
Durch unsere aktuellen Arbeiten wollen wir die Wirkung des noch nicht gut untersuchten Toxins DrT aufklären und den Mechanismus, der ebenfalls auf den VLEs kodierten Immunität verstehen. Erstaunlicherweise schützen DNA Reparaturmechanismen vor der Wirkung des Translationsinhibitors PaT. Der durch diese Tatsache evident gewordene und bislang unbekannte Zusammenhang zwischen Translationsintegrität und Genomüberwachung ist Gegenstand weiterer Untersuchungen.