|
Eisen, das häufigste Übergangsmetall in der Erdkruste,
spielt in mehr biologischen Prozessen eine Schlüsselrolle
als irgendein anderes Metall. Grund dafür sind vor allem die
Lewis-Acidität des Eisen(III) und die günstige Redoxaktivität
des Eisen(III/II)-Paares. Neben den Hämproteinen, wie Hämoglobin und Cytochrom
C, und Eisen-Schwefel-Proteinen, wie Nitrogenasen und Hydrogenasen,
existiert die Gruppe der Nicht-Häm-Eisenenzyme. Die Proteine
dieser Gruppe enthalten eine unterschiedliche Anzahl an Eisenkernen.
Zu den mononuklearen Nicht-Häm-Eisenenzymen gehören unter
anderem die Superoxid-Dismutasen, Isopenicillin-N-Synthasen, Lipoxygenasen
und Catechol-1,2-Dioxygenasen. Letztere katalysieren den Abbau aromatischer
1,2-Diphenole zu Derivaten der cis,cis-Muconsäure und spielen damit eine
wichtige Rolle im globalen Kohlenstoffzyklus. Für die Modellierung des aktiven Zentrums der Catechol-1,2-Dioxygenasen
haben sich Eisenkomplexe tripodaler Liganden bewährt.
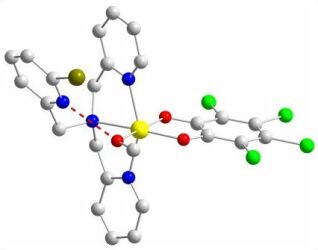
Durch Variationen der verwendeten Liganden können sterische und elektronische Einflüsse auf die Reaktivität der Modellverbindungen untersucht, und Rückschlüsse auf die zugrundeliegenden Reaktionsmechanismen im Enzym gezogen werden. Die Abbildung zeigt einen der untersuchten Komplexe, der als besonderes Merkmal eine intramolekulare Wasserstoffbrückenbindung aufweist.
Die dinuklearen Enyzme nehmen in vielen Organismen Funktionen im
Bereich der Sauerstoffaktivierung und des Sauerstofftransports war.
Die Methan-Monooxygenase katalysiert die Oxidation von Methan zu
Methanol. Von tierischen Violetten Sauren Phosphatasen, wie z.B dem
Uteroferrin, wird angenommen, dass sie neben der Spaltung von Phophatmonoestern
auch Aufgaben im Bereich der Sauerstoffübertragung wahrnehmen.
In biomimetischen Modellverbindungen für diese Enzyme wird mit
Ligandensystemen gearbeitet, die in der Lage sind, eine Koordinationsumgebung
für zwei Metallatome bereitzustellen. Von asymmetrischen Liganden
dieses Typ werden den Metallen unterschiedliche Koordinationsumgebungen
angeboten. Die entsprechenden Komplexe sind in der Lage, Wasserstoffperoxid
zu addieren und für Peroxidasereaktionen zu aktivieren. Mit
Hilfe von Stopped-Flow-Messungen wurde die Geschwindigkeit der Anbindung
untersucht.
Ein anderer Weg zu zweikernigen Eisenkomplexen ist die Kopplung
von zwei einkernigen Spezies. Dabei kommt der Wahl des/der verbrückenden
Liganden eine entscheidende Rolle zu. Bis-µ-oxoverbrückte
Spezies weisen Eisen-Eisen-Abstände von ca. 2.7 Angström
auf, µ-oxo-µ-carboxylatoverbrückte Komplexe von etwa 3.2 Angström. Bei Bis-µ-phosphatoverbrückten
Komplexen kommt es zu Eisen-Eisen-Abständen von bis zu 5 Angström.
Alle neuen Verbindungen werden mittlels Röntgenstrukutranalysen
und verschiedener spektroskopischer Methoden untersucht und charakterisiert.
 Seitenanfang Seitenanfang
Kooperationspartner
Prof.
Dr. S. Schindler (Universität Giessen)
Veröffentlichungen
- M. Merkel, M. Pascaly, B. Krebs, J. Astner, S. P. Foxon, S. Schindler
"Chelate Ring Size Variations and their Effects on Coordination
Chemistry and Catechol Dioxygenase Reactivity of Iron(III) complexes"
Inorg. Chem. 2005, angenommen.
- M. Merkel, D. Schnieders, S. M. Baldeau, B. Krebs
Structural snapshots of a dynamic coordination sphere in model
complexes for catechol 1,2-dioxygenases"
Eur. J. Inorg. Chem. 2004, 783
- G.
V. Nizova, B. Krebs, G. Süss-Fink, S. Schindler, L. Westerheide,
L. Gonzales Cuervo and G. B. Shul´pin
"Hydroperoxidation of methane and other alkanes with H2O2
catalyzed by a dinuclear iron complex and an amino acid"
Tetrahedron 2002, 58, 9231
-
M. Merkel, F. K. Müller, B. Krebs
"Novel iron(III) complexes with phenolate containing tripodal
tetradentate ligands as model systems for catechol 1,2-dioxygenases"
Inorg. Chim. Acta 2002, 337, 308
- M.
Pascaly, M. Duda, F. Schweppe, F. K. Müller, K. Zurlinden
u. B. Krebs
"The systematic influence of tripodal ligands on the catechol
cleaving activity of iron(III) containing model compounds for
catechol 1,2-dioxygenases"
J. Chem. Soc. Dalton Trans. 2001, 6, 828
- L.
Westerheide, F. K. Müller, J. Dietrich, R. Than, B. Krebs
u. S. Schindler
"Synthesis and Structural Characterization of Dinuclear and
Tetranuclear Iron(III) Complexes and their Reactions with Hydrogen
Peroxide"
Inorg. Chem. 2001, 40, 1951
- L.
Westerheide, M. Pascaly u. B. Krebs
"Methane Monooxygenase and Its Related Biomimetic Models"
Curr. Opin. in Chem. Biol. 2000, 4, 235
- M.
Pascaly, C. Nazzikol, F. Schweppe, A. Wiedemann, K. Zurlinden
u. B. Krebs
"Structures and Properties of Novel Mononuclear Iron(III)
Complexes with Benzimidazole Containing Tripodal Ligands"
Z. Anorg. Allg. Chem. 2000, 626, 50
- F.
Schweppe, H. Sirges, M. Pascaly, M. Duda, C. Nazzikol, W. Steinforth
u. B. Krebs
"Transition Metal Catalyzed Oxy-Functionalization of Catechol
and Flavonol Derivatives"
in: Peroxide Chemistry; Mechanistic and Preparative Aspects
of Oxygen Transfer, Wiley-VCH 2000, S. 232
- M.
Pascaly, F.Schweppe u. B. Krebs
"Electron transfer mediated substrate activation by model
compounds for catechol 1,2-dioxygenase", J.
Inorg. Biochem. 1999, 74, 260
- R.
Than, A. Schrodt, L. Westerheide, R. van Eldik u. B. Krebs
"Structural and Functional Investigations on Diiron Complexes:
Catalase-like Activity and Mechanistic Studies on the Formation
of (µ-Peroxo)diiron(III) Adducts "
Eur. J. Inorg. Chem. 1999, 1537
- M.
Pascaly, M. Duda, A. Rompel, B.H. Sift, W. Meyer-Klaucke u. B.
Krebs
"Novel iron(III) complexes with imidazole containing tripodal
ligands as model systems for catechol dioxygenases"
Inorg. Chim. Acta 1999, 291,
289
- D.
Harms, R. Than, B. Krebs u. U. Karst
" Flow injection analysis of hydrogen peroxide in disinfectants.
"
Fresenius J. Anal. Chem. 1999, 364, 184
- R.
Than, A. A. Feldmann u. B. Krebs
" Structural and functional studies on model compounds of
purple acid phosphatases and catechol oxidases."
Coord. Chem. Rev. 1998, 182, 209
- D.
Harms, R. Than, U. Pinkernell, M. Schmidt, B. Krebs u. U. Karst
"Selective determination of hydrogen peroxide in household
products using its molecular recognition by a dinuclear iron(III)
complex."
Analyst. 1998, 123, 2323
- M.
Duda, M. Pascaly u. B. Krebs
"A highly reactive functional model for catechol 1,2-dioxagenase:
reactivity studies of iron(III)-catecholate complexes of bis((2-pyridyl)methyl)((1-methylimidazol-2-yl)-methyl)
amine."
J. Chem. Soc., Chem. Commun. 1997, 835
- B.
Krebs, F. Ahlers, B. Bremer, B. Eulering, T. Klabunde, K. Schepers,
M. Schmidt, N. Sträter, R. Than u. H. Witzel
"Crystal structure of a purple acid phosphatase. Structural
and functional studies on its model compounds. "
In: " Bioinorganic Chemistry" 1997, 413
- B.
Eulering, M. Schmidt, U. Pinkernell, U. Karst u. B. Krebs
"Ein unsymmetrischer dinuklearer Eisen(III)-Komplex mit Peroxidaseeigenschaften"
Angew. Chem. 1996, 108, 2102; Angew. Chem.
Int. Ed. Engl. 1996, 35, 1973
- C.
Nazikkol, R. Wegner, J. Bremer u. B. Krebs
"Tripodal Ligands: Design of Distorted Coordination Polyhedra
in Biomimetic Metal Complexes. Crystal Structures of [Zn(SCN)(ntb)](SCN)·iPrpOH
and [Fe(acac)(ntb)](ClO4)2·2CH2Cl2·iPrpOH,
ntb = N-tris(2-benzimidazolyl-methyl)amine"
Z. Anorg. Allg. Chem. 1996, 622, 213
- B.
Eulering, M. Schmidt, U. Pinkernell, U. Karst u. B. Krebs
"A New Unsymmetrical Model Compound for the Uteroferrin-Arsenato
Complex and Oxidation of Different Substrates by Diferric Peroxo
Complexes"
J. Inorg. Biochem. 1995, 59, 403
- B.
Eulering, F. Ahlers, F. Zippel, M. Schmidt, H.-F. Nolting u. B.
Krebs
"The First Diferric Model Compound for the Uteroferrin-Arsenato
Complex"
J. Chem. Soc. Chem. Commun. 1995, 1305
 Seitenanfang Seitenanfang |

