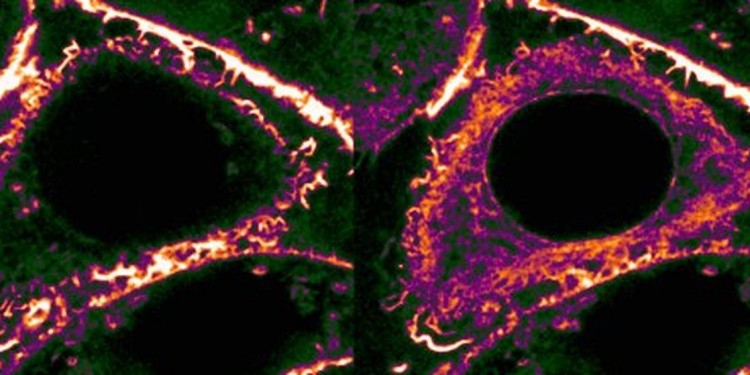
"Gestresste" Zellen reagieren mit Änderungen ihrer Struktur
Hektik im Job, Ärger mit den Kindern und Ebbe auf dem Konto: Wenn mal wieder alles zu viel wird, kann es helfen, sich neu zu sortieren. Sind Zellen im "Superstress", beispielsweise durch mechanische Verletzungen, durchlaufen sie ebenfalls eine grundlegende Umgestaltung. Dabei geht es um ihr Zellskelett, das aus vielen einzelnen Bausteinen hochflexibel immer neue Strukturen bildet, etwa um die Zelle zu stützen oder um molekulare Lasten zu transportieren. Ein Team um Prof. Dr. Roland Wedlich-Söldner vom Exzellenzcluster "Cells in Motion" der Universität Münster konnte diesen Prozess im Detail aufklären. Die Forscher zeigten, dass der zelluläre "Neustart" wichtig ist für Prozesse bei der Reparatur und Wundheilung und dass er auch bei der Zellwanderung, bei Krebs und bei Entzündungen eine Rolle spielen könnte. Die Publikation ist jetzt im Fachjournal "eLife" erschienen.
Gehen Zellen auf "Los" zurück, ziehen sie ein Strukturprotein des Zellskeletts – das Aktin – in ihr Inneres ein. Der Hintergrund: Schäden der äußeren Membran und andere Störungen können Zellen unter Druck bringen, was sich oft über ein universelles Stress-Signal ausdrückt. In kurzer Zeit strömt dann eine große Menge Kalzium in die Zelle ein. "Wir können im Mikroskop sehen, dass das enorme Auswirkungen auf das Zellskelett hat", sagt Roland Wedlich-Söldner. "Besonders betroffen davon sind die sogenannten Aktin-Fasern, die an der Innenseite der Zellmembran ein dichtes Netzwerk bilden, das die Zelle stützt und ihre äußere Form bewahrt." Gleich nachdem das Kalzium eingeströmt ist, werden diese Außenposten abgezogen und nahe dem Zellkern angelagert. Diesen Prozess nennen die Forscher "Calcium-mediated Actin Reset" (CaAR).
Ein Faktor ist für diesen Rückzug entscheidend, wie die Forscher zeigen konnten: das Protein INF2. Es kontrolliert sowohl den blitzartigen Abbau des Aktin-Netzwerks als auch den Aufbau der neuen Filamente, fadenförmige Strukturen im Zellinneren. Lange hält die Umverteilung aber nicht, denn schon nach wenigen Minuten ist das Kalzium wieder aus der Zelle gepumpt und das Aktin-Netzwerk bildet sich an der Innenseite der umgebenden Zellmembran wieder auf. Alles umsonst also? "Entscheidend ist, dass CaAR den Zellen erlaubt, den sensiblen Bereich nahe der Zellmembran in sehr kurzer Zeit und auf drastische Weise als Antwort auf Stress umzugestalten", sagt Roland Wedlich-Söldner. Im Handumdrehen könnten damit die Strukturen des Zellskeletts an neue Anforderungen in der jeweiligen Stress-Situation angepasst werden – mit weitreichenden Auswirkungen in der Zelle.
So konnten die Forscher zeigen, dass der dramatische Umbau des Aktin-Netzwerks auch die Aktivität bestimmter Gene verändern kann. Die kurzzeitige Stress-Antwort kann auf diesem Weg zu Langzeiteffekten im Verhalten der Zelle, beispielsweise in ihren Bewegungen, führen. CaAR hat eine außerordentlich weitreichende Bedeutung, nehmen die Forscher an. Denn die Ergebnisse der Studie, die bei vielen verschiedenen Zellen von Säugetieren bestätigt wurden, zeigen eine Rolle von CaAR bei Reparaturprozessen und bei der Wundheilung. Sie lassen auch vermuten, dass Kalzium bei Stress generell die Organisation von Aktin und damit die Form sowie die Bewegung von Zellen beeinflussen könnte, etwa bei Entzündungen und Krebs. "Wir wollen jetzt in weiterführenden Studien untersuchen, ob und welche Rolle CaAR dabei spielt", sagt Roland Wedlich-Söldner.
Die Studie wurde vom Exzellenzcluster "Cells in Motion" und vom Sonderforschungsbereich 1009 "Breaking Barriers" der Universität Münster unterstützt.
Originalpublikation: Wales P. et al.: Calcium-mediated actin reset (CaAR) mediates acute cell adaptations. Published December 6, 2016; eLife, 2016, DOI: 10.7554/eLife.19850
